- 344.16 KB
- 11页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'分光光度法测BPB电力平衡常数【Authorandinstitutionofthereport】PB11207027zhanghengSchoolofLifeSciences.UniversityofScienceandTechnologyofChina.HefeiCity.AnhuiProvince.Postcode:230026Email:zh322523@mail.ustc.edu.cn【Abstract】ThisexperimentutilizespectrophotometertofindoutthemaximumabsorptionwavelengthofBPB,andthenmeasureabsorbanceindifferentpH,inordertocalculateequilibriumconstantofionizationofBPB.【Keywords】SpectrophotometerBromophenolblueMaximumabsorptionwavelengthAbsorbanceTheequilibriumconstantofionization【前言】物质分子对光的吸收是物质分子中的价电子从最高占有轨道向最低空轨道跃迁。溶液对单色光的吸收遵守贝尔—朗比定律。每一种物质有自己特征的最大吸收波长。波长为λ的单色光通过
任何均匀而透明的介质时,由于物质对光的吸收作用而使透射光的强度比入射光的强度要弱,其减弱的程度与所用的波长(λ)有关。分子结构不同的物质,对单色光的吸收有选择性。溴酚蓝是一种酸碱指示剂,本身带有颜色且在有机溶剂中电离度很小,所以用一般的化学分析法或其他物理化学方法很难测定其电离平衡常数。本实验用分光光度法测定弱电解质溴酚蓝的电离常数,可以得到比较精确的结果。【实验部分】1、实验试剂实验试剂-55×10mol/L溴酚蓝溶液0.1mol/L邻苯二甲酸氢钾溶液0.10mol/LHCl溶液0.10mol/LNaOH溶液1.0mol/LHCl溶液0.20mol/LNaOH溶液2、实验仪器HK-2A型超级恒温水浴锅一台TU-1901双光束紫外可见分光光度计一台pH计一台10ml移液管三支25ml移液管一支50ml移液管一支3、实验原理波长为λ的单色光通过任何均匀而透明的介质时,由于物质对光的吸收作用而使透射光的强度(I)比入射光的强度(I0)要弱,其减弱的程度与所用的波长(λ)有关。又因分子结构
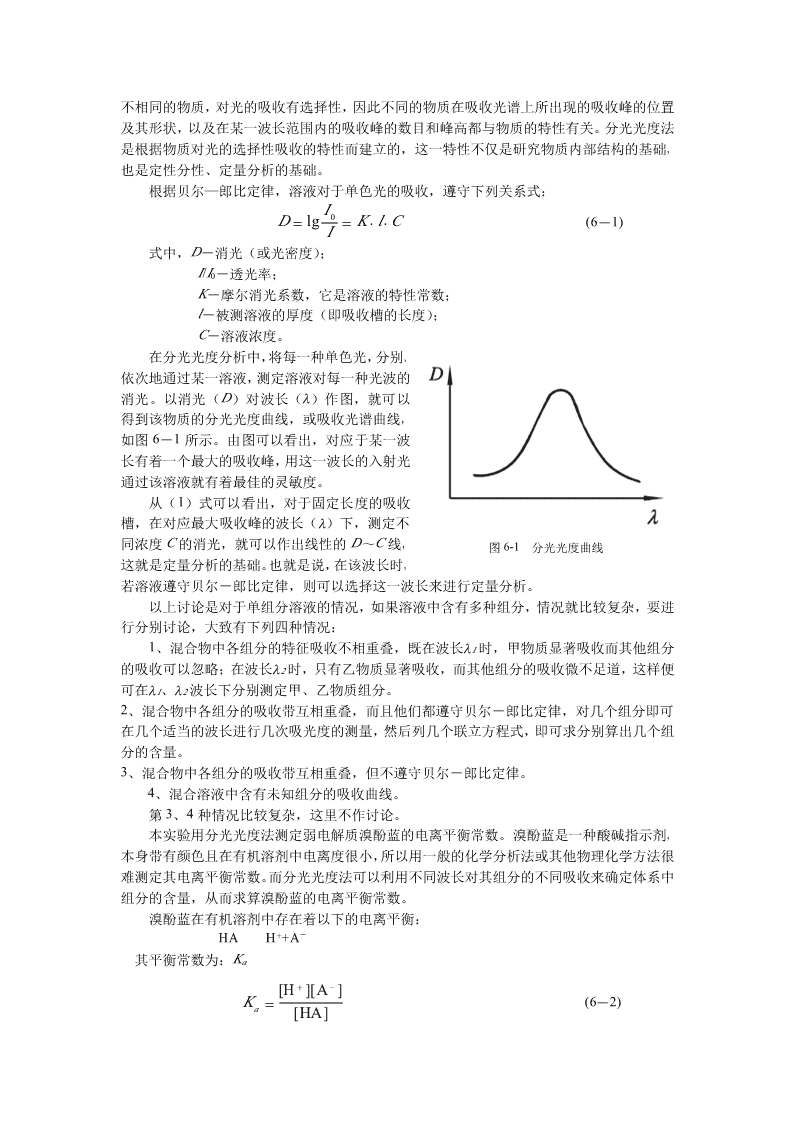
不相同的物质,对光的吸收有选择性,因此不同的物质在吸收光谱上所出现的吸收峰的位置及其形状,以及在某一波长范围内的吸收峰的数目和峰高都与物质的特性有关。分光光度法是根据物质对光的选择性吸收的特性而建立的,这一特性不仅是研究物质内部结构的基础,也是定性分性、定量分析的基础。根据贝尔—郎比定律,溶液对于单色光的吸收,遵守下列关系式:I0D=lg=K⋅l⋅C(6-1)I式中,D-消光(或光密度);I/I0-透光率;K-摩尔消光系数,它是溶液的特性常数;l-被测溶液的厚度(即吸收槽的长度);C-溶液浓度。在分光光度分析中,将每一种单色光,分别、依次地通过某一溶液,测定溶液对每一种光波的消光。以消光(D)对波长(λ)作图,就可以得到该物质的分光光度曲线,或吸收光谱曲线,如图6-1所示。由图可以看出,对应于某一波长有着一个最大的吸收峰,用这一波长的入射光通过该溶液就有着最佳的灵敏度。从(1)式可以看出,对于固定长度的吸收槽,在对应最大吸收峰的波长(λ)下,测定不同浓度C的消光,就可以作出线性的D~C线,图6-1分光光度曲线这就是定量分析的基础。也就是说,在该波长时,若溶液遵守贝尔-郎比定律,则可以选择这一波长来进行定量分析。以上讨论是对于单组分溶液的情况,如果溶液中含有多种组分,情况就比较复杂,要进行分别讨论,大致有下列四种情况:1、混合物中各组分的特征吸收不相重叠,既在波长λ1时,甲物质显著吸收而其他组分的吸收可以忽略;在波长λ2时,只有乙物质显著吸收,而其他组分的吸收微不足道,这样便可在λ1、λ2波长下分别测定甲、乙物质组分。2、混合物中各组分的吸收带互相重叠,而且他们都遵守贝尔-郎比定律,对几个组分即可在几个适当的波长进行几次吸光度的测量,然后列几个联立方程式,即可求分别算出几个组分的含量。3、混合物中各组分的吸收带互相重叠,但不遵守贝尔-郎比定律。4、混合溶液中含有未知组分的吸收曲线。第3、4种情况比较复杂,这里不作讨论。本实验用分光光度法测定弱电解质溴酚蓝的电离平衡常数。溴酚蓝是一种酸碱指示剂,本身带有颜色且在有机溶剂中电离度很小,所以用一般的化学分析法或其他物理化学方法很难测定其电离平衡常数。而分光光度法可以利用不同波长对其组分的不同吸收来确定体系中组分的含量,从而求算溴酚蓝的电离平衡常数。溴酚蓝在有机溶剂中存在着以下的电离平衡:+-HAH+A其平衡常数为:Ka+−[H][A]K=(6-2)a[HA]
-溶液的颜色是由显色物质HA与A引起的,其变色范围PH在3.1~4.6之间,当PH≤3.1-时,溶液的颜色主要由HA引起的,呈黄色;在PH≥4.6时,溶液的颜色主要由A引起,呈蓝色。实验证明,对蓝色产生最大吸收的单色光的波长对黄色不产生吸收,在其最大吸收波长时黄色消光为0或很小。因此,本实验我们所研究的体系应属于上述讨论的第一种情况。--用对A产生最大吸收波长的单色光测定电离后的混合溶液的消光,可求出A的浓度。令-A在显色物质中所占的分数为X,则HA所占的摩尔分数为1-X,所以X−K=[A](6-3)a1−XX或者写成:lg=PH+lgK(6-4)a1−X-根据上式可知,只要测定溶液的PH值及溶液中的[HA]和[A],就可以计算出电离平衡常数Ka。在极酸条件下,HA未电离,此时体系的颜色完全由HA引起,溶液呈黄色。设此时体-系的消光度为D1;在极碱条件下,HA完全电离,此时体系的颜色完全由A引起,此时的消光度为D2,D为两种极端条件之间的诸溶液的消光度,它随着溶液的PH而变化,D=(1-X)D1+XD2。D−D1X=D−D2代入(4)式中得:D−D1lg=PH−PK(6-5)aD−D2D−D1在测定D1、D2后,再测一系列PH下的溶液的光密度,以lg对PH作图应为一D−D2直线,由其在横轴上的截距可求出PKa,从而可得该物质的电离平衡常数。本实验的PH值通过溶液配制而得。4、实验步骤1、打开超级恒温水浴使之恒温在25℃,打开分光光度计,预热仪器,同时掀开样品室盖。2、确定溶液的最大吸收波长。(1)用20mL移液管准确移取5×10-5mol-3·dm的B.P.B溶液20mL,置于一个洗干净的100mL的容量瓶中,并用50ml的移液管准确加入50mL0.1mol-3·dm的邻苯二甲酸氢钾缓冲溶液,加H-5-32O稀释到刻度,得1.0×10mol·dm的B.P.B溶液。(2)取1cm厚度的比色皿两只,分别用H2O和1.0×10-5mol·dm-3的B.P.B溶液洗净,再分别装入2/3体积的H2O和1.0×10-5mol·dm-3的B.P.B溶液,把比色皿两光面擦干,正确插入光度计恒温比色槽中,用蒸馏水作空白溶液,用以校正仪器。放在最外面的一个槽内便于测量。(3)认真阅读书后附录,了解722分光光度计的使用和操作及注意事项。(4)在480-630nm波长范围内,从低到高逐一选择仪器的入射光波长,用空白溶液蒸馏水在T档校正仪器的0点和100,并用吸光旋钮调H2O的吸光度为0,再测量两种不同溶液的吸光度。在480-560的范围内每隔10nm测一次,在560-600nm范围内每隔5nm测一次。将所得的结果以吸光度D对λ作图,或从测量数据直接读出B.P.B溶液的最大吸收
波长。3、各个不同酸度的溴酚蓝溶液配置。取7只100mL的干净容量瓶,分别加入20mL5×10-5mol-3·dm的B.P.B溶液,再分别加入50mlL0.1mol-3·dm邻苯二甲酸氢钾溶液。加入的HCl和NaOH的量以下表为准,再加稀释至刻度。可分别得到不同PH值下的B.P.B溶液。溶液号PH值X1(0.1mol·dm-3HCl)溶液号PH值X1(0.1mol·dm-3NaOH)1~3.216.00mL5~4.23.00mL2~3.410.00mL6~4.47.00mL3~3.66.00mL7~4.611.00mL4~3.83.00mL4、不同酸度下,溴酚蓝溶液pH值的测定。将上述七种不同酸度的溴酚蓝溶液用酸度计测量相应的pH值。5、不同酸度下,溴酚蓝溶液吸光度D的测定。(1)将波长固定在λmax处,把已经恒温的溶液逐一以蒸馏水作参比,测量其吸光度,可得一系列的D值。由于在λmax的波长下,对HA不产生吸收,所以此时的D-是A的吸收提供的。测量过程中注意溶液恒温。(2)取两只100mL容量瓶,分别加入20mL5×10-5mol-3·dm的B.P.B溶液。在一支容量瓶中加入50mL0.2mol-3·dm的NaOH溶液稀释到刻度,得B.P.B的极碱溶液,在另一支容量瓶中加入1mol-3·dm的HCl溶液10mL,稀释至刻度,得B.P.B的极酸溶液。(3)在分光光度计上迅速测量极酸溶液、极碱溶液的吸光度D1和D2,测量结果应表明,极酸时溶液呈黄色,在λmax情况下,测得的吸光度为0。〖结果与讨论〗1、D-λ图
Abs0.350.300.250.200.15Abs0.100.050.00480500520540560580600620640660nmD-D2、1-pH图:lgD-D2Equationy=a+b*xWeightNoWeightingBResidualSumof0.00221SquaresLinearFitofBAdj.R-Square0.998350.6ValueStandardErrorIntercept-3.306830.05332BSlope0.893250.01480.40.20.0-0.2-0.4-0.6-0.82.62.83.03.23.43.63.84.04.24.4截距为-3.31,∴pKa=3.31,-4K=4.90×10a查得BPB的电离平衡常数为:PKa=4.10|pKa-pKa||3.31-4.10|相对误差0δ=×100%=×%=19.3%pKa4.100
3、实验总结与误差分析:1、系统误差实验中用到的移液管、容量瓶及PH计、分光光度计都存在一定的仪器误差,还存在一定的估读误差。分光光度计调零时示数会有波动,不可能做到完全精确。分光光度计、pH计读数会有波动,不可能读到准确的值,要估读必会有误差。2、偶然误差测量次数的有限性导致了偶然误差的产生。在本实验中,没有进行多次平行测量,因此偶然误差也会较大。3、实验中由于恒温槽控温机制的限制,不可能绝对恒温。而且实验过程较长,室温变化较大。测pH是在室温下进行的,受影响也会较大。4、将所测溶液用分光光度计测吸光值时,由于从室温转入预设的温度,所以BPB电离常数会有变化,分光光度示数也会有波动。所以,要等到示数基本不变后再读数。5、BPB的电离常数会随温度变化而变化,测pH是在室温下进行的,而测吸光值是在预设的温度下进行的。因此溶液测pH的电离度与测吸光值时的会有不同。两温度下的pH会有偏差。但由于温度基本相等,误差可以忽略。6、实验中要求迅速测量极酸和极碱溶液的吸光度,否则溶液会发生变化。其实,这种变化不可能完全避免。理论上极酸情况下吸光值应为零。但实际测量为-0.007,略有偏差。
7、BPB的电离常数理论值应该用H+和A-的活度值计算:aH+⋅aA−K=aaHA而实验中使用的是浓度计算。其中实验所测的吸光值直接反映了-A的浓度。随着溶液中离子强度的增加,浓度值会与活度值有较大偏离。但实验是在浓度较低时进行的,活度与浓度近似相等,因此影响不是很大。8、电极测pH后,尽管用水冲洗并擦干,但仍会有残留。因为很难彻底洗净,彻底擦干。9、测量最大吸收波长时,每隔5nm测一次,因此还不够精确。最大吸收波长的的确定,会给实验测吸光值的误差大小带来影响。但此影响不会太大。10、用比色皿测吸光值,尽管润洗,但与所配溶液浓度也会有偏差。11、由于所作的直线是通过截距来确定Ka,误差会比同过斜率来确定的相对较大。尤其所测的点是离y轴较远。但对本实验来说,误差不是很大。12、综上几点原因,使得实验值与理论值之间存在一定差距。由所作的直线拟合度为0.99873可知,影响因素一定程度上可以忽略。该实验是比较精确地测出Ka。13、该实验设计的成功之处在于利用BPB在低浓度下,吸光值与浓度(活度)成正比,以吸光值来反映浓度。且BPB在低浓度下,在最大吸收波长下,吸光值仍较大,使实验具有可行性。〖参考文献〗《物理化学实验》崔献英等编著中国科学技术大学出版社
《物理化学》傅献彩等编高等教育出版社《普通化学原理》华彤文等编北京大学出版社《物理化学》(美)V.弗里德等著高等教育出版社,1983年7月附:数据处理:�溴酚蓝的性质:【分子式】C19H10Br4O5S【名称】3′,5,5′-四溴苯酚磺酰酞【英文名称】Bromophenolblue;Albutest【相对分子量或原子量】670.02【性状】从乙酸及丙酮混合液中析出者为长六角形棱柱状结晶。恒温槽温度:25.0℃1、最大波长由数据在Origin上作图得:消光——波长图像Abs0.350.300.250.200.15Abs0.100.050.00480500520540560580600620640660nm由机器读出最大波长为592.00nm。
2、K的测定;a极酸:D1=-0.001极碱:D2=0.630pHDD-D1lgD-D22.780.087-0.7903.040.124-0.6073.270.178-0.4023.470.235-0.2243.900.3780.1774.140.4470.3894.330.4980.578D-D以1lg对pH作图:D-D2Equationy=a+b*xWeightNoWeightingBResidualSumof0.00221SquaresLinearFitofBAdj.R-Square0.99835D-D0.6ValueStandardError1Intercept-3.306830.05332lgBSlope0.893250.0148D2-D0.40.20.0-0.2-0.4-0.6-0.82.62.83.03.23.43.63.84.04.24.4pH截距为-3.31,∴pKa=3.31,-4K=4.90×10a查得BPB的电离平衡常数为:PKa=4.10
|pKa-pKa||3.31-4.10|相对误差0δ=×100%=×%=19.3%pKa4.100'
您可能关注的文档
- 分光光度法测定高放废液中的铀_张丽华
- 原子吸收分光光度法分析手册第3册火焰测定条件
- 实验5 分光光度法测定水中总铁
- 实验5 分光光度法测定水中总铁
- 实验5 分光光度法测定水中总铁
- 实验5 分光光度法测定水中总铁
- 实验5 分光光度法测定水中总铁
- YS∕T 990.8-2014 冰铜化学分析方法 第8部分:砷量的测定氢化物发生—原子荧光光谱法、二乙基二硫代氨基甲酸银分光光度法和溴酸钾滴定法
- YS∕T 990.10-2014 冰铜化学分析方法 第10部分:二氧化硅量的测定硅钼蓝分光光度法和氟硅酸钾滴定法
- 紫外_可见分光光度法在植物多糖含量测定中的应用_苏玉顺
- 论文 分光光度法测溴酚蓝的电离平衡常数
- 原子吸收分光光度法测定奶粉中的钙
- 实验四紫外-可见分光光度法测物质吸收和透过光谱
- 有关原子分光光度法
- 铁氰化钾分光光度法测定白砂糖中的还原糖分
- 紫外-可见分光光度法
- 紫外分光光度法鉴定未知芳香化合物及萘的测定
- 紫外可见分光光度法实验