- 622.50 KB
- 9页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
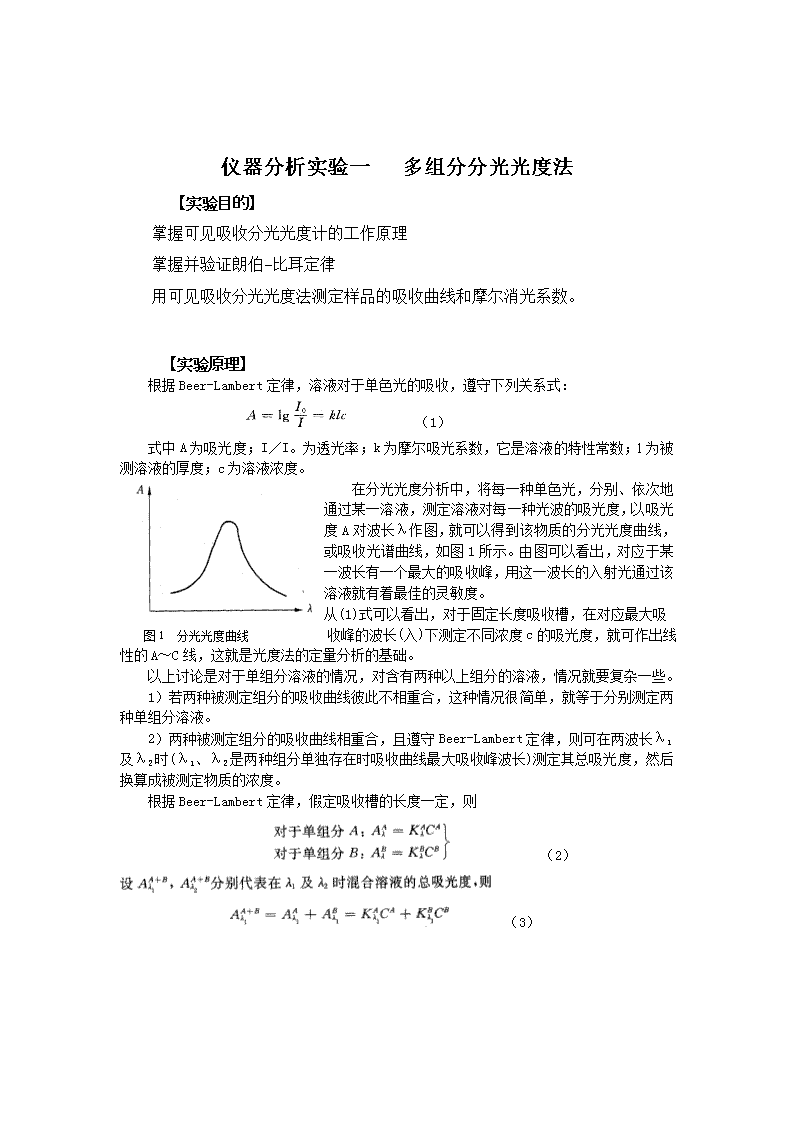
'仪器分析实验一多组分分光光度法【实验目的】掌握可见吸收分光光度计的工作原理掌握并验证朗伯-比耳定律用可见吸收分光光度法测定样品的吸收曲线和摩尔消光系数。【实验原理】根据Beer-Lambert定律,溶液对于单色光的吸收,遵守下列关系式:(1)式中A为吸光度;I/I。为透光率;k为摩尔吸光系数,它是溶液的特性常数;l为被测溶液的厚度;c为溶液浓度。在分光光度分析中,将每一种单色光,分别、依次地通过某一溶液,测定溶液对每一种光波的吸光度,以吸光度A对波长λ作图,就可以得到该物质的分光光度曲线,或吸收光谱曲线,如图1所示。由图可以看出,对应于某一波长有一个最大的吸收峰,用这一波长的入射光通过该溶液就有着最佳的灵敏度。从(1)式可以看出,对于固定长度吸收槽,在对应最大吸图1分光光度曲线收峰的波长(入)下测定不同浓度c的吸光度,就可作出线性的A~C线,这就是光度法的定量分析的基础。以上讨论是对于单组分溶液的情况,对含有两种以上组分的溶液,情况就要复杂一些。1)若两种被测定组分的吸收曲线彼此不相重合,这种情况很简单,就等于分别测定两种单组分溶液。2)两种被测定组分的吸收曲线相重合,且遵守Beer-Lambert定律,则可在两波长λ1及λ2时(λ1、λ2是两种组分单独存在时吸收曲线最大吸收峰波长)测定其总吸光度,然后换算成被测定物质的浓度。根据Beer-Lambert定律,假定吸收槽的长度一定,则(2)(3)
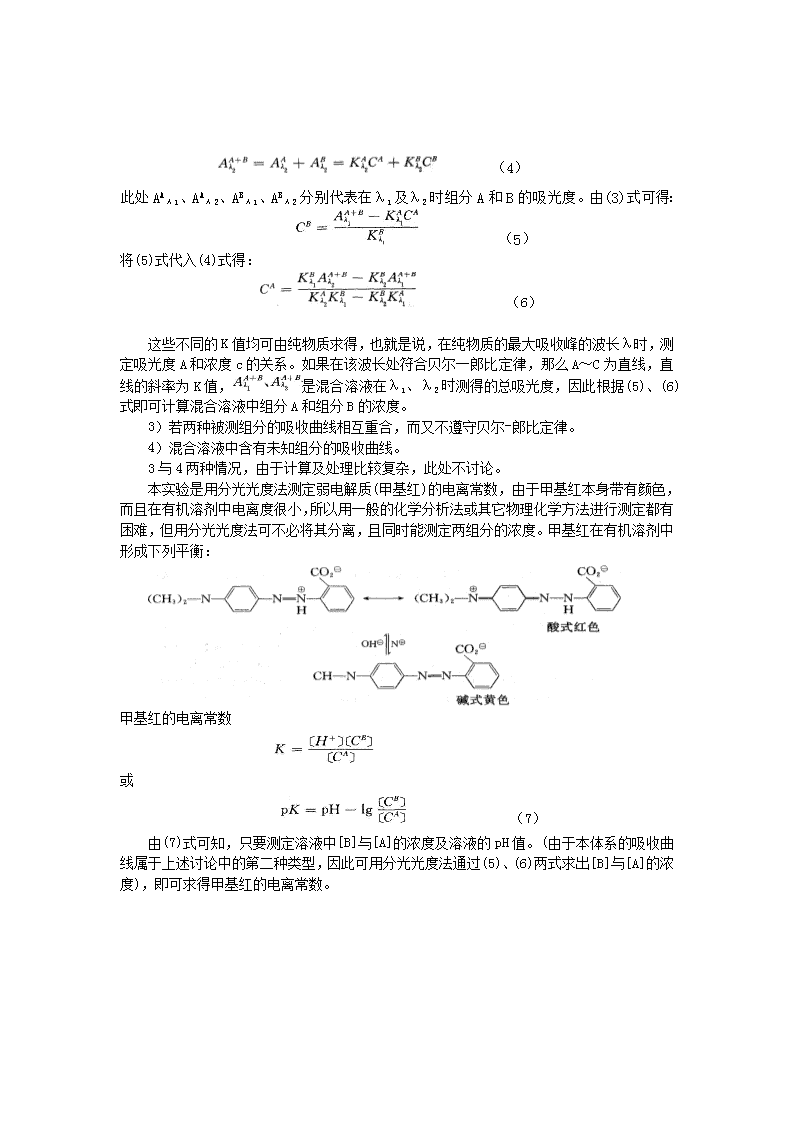
(4)此处AAλ1、AAλ2、ABλ1、ABλ2分别代表在λ1及λ2时组分A和B的吸光度。由(3)式可得:(5)将(5)式代入(4)式得:(6)这些不同的K值均可由纯物质求得,也就是说,在纯物质的最大吸收峰的波长λ时,测定吸光度A和浓度c的关系。如果在该波长处符合贝尔一郎比定律,那么A~C为直线,直线的斜率为K值,是混合溶液在λ1、λ2时测得的总吸光度,因此根据(5)、(6)式即可计算混合溶液中组分A和组分B的浓度。3)若两种被测组分的吸收曲线相互重合,而又不遵守贝尔-郎比定律。4)混合溶液中含有未知组分的吸收曲线。3与4两种情况,由于计算及处理比较复杂,此处不讨论。本实验是用分光光度法测定弱电解质(甲基红)的电离常数,由于甲基红本身带有颜色,而且在有机溶剂中电离度很小,所以用一般的化学分析法或其它物理化学方法进行测定都有困难,但用分光光度法可不必将其分离,且同时能测定两组分的浓度。甲基红在有机溶剂中形成下列平衡:甲基红的电离常数或(7)由(7)式可知,只要测定溶液中[B]与[A]的浓度及溶液的pH值。(由于本体系的吸收曲线属于上述讨论中的第二种类型,因此可用分光光度法通过(5)、(6)两式求出[B]与[A]的浓度),即可求得甲基红的电离常数。
【仪器试剂】(1)722N型可见分光光度计;容量瓶(100ml,25ml);量筒;烧杯;移液管(25ml;5ml);滴管,比色皿。(2)95%乙醇(A.R.);HCl(0.1mol·dm-3);甲基红(A.R.);醋酸钠(0.05mol·dm-3、0.01mol·dm-3)。【实验步骤】1.制备溶液(1)甲基红溶液称取0.400g甲基红,加入300mL95%的乙醇,待溶后,用蒸馏水稀释至500mL容量瓶中。(2)甲基红标准溶液取10.00mL上述溶液,加入50mL95%乙醇,用蒸馏水稀释至100mL容量瓶中。(3)溶液a取10.00mL甲基红标准溶液,加入0.1mol·dm-3盐酸10mL,用蒸馏水稀释至100mL容量瓶中。(4)溶液b取10.00mL甲基红标准溶液,加入0.05mol·dm-3醋酸钠20mL,用蒸馏水稀释至100mL容量瓶中。将溶液a、b和空白液(蒸馏水)分别放入三个洁净的比色皿内。2.吸收光谱曲线的测定接通电压,预热仪器。测定溶液a和溶液b的吸收光谱曲线,求出最大吸收峰的波长λa和λb。波长从380nm开始,每隔20nm测定一次,在吸收高峰附近,每隔5nm测定一次,每改变一次波长都要用空白溶液校正,直至波长为600nm为止。作A-λ曲线。求出波长λa和λb值。3.验证朗伯-比耳定律,并求出(1)分别移取溶液a5.00mL、10.00mL、15.00mL、20.00mL分别于四个25mL容量瓶中,然后用0.01mol·dm-3盐酸稀释至刻度,此时甲基红主要以[HMR]形式存在。(2)分别移取溶液b5.00mL、10.00mL、15.00mL、20.00mL分别于四个25mL容量瓶中,用0.01mol·dm-3醋酸钠稀释至刻度,此时甲基红主要以[MR-]形式存在。(3)在波长为λa、λb处分别测定上述各溶液的吸光度A。如果在λa、λb处,上述溶液符合朗伯-比耳定律,则可得四条A-C直线,由此可求出值。
【数据记录】1.纯酸式与纯碱式最高吸收峰的测定纯酸式在不同波长下的吸光度波长λ/nm380400420440460480500吸光度A0.0610.0550.0940.1990.3990.7091.031波长λ/nm505510515520525530535吸光度A1.0941.1431.1781.1801.1821.1591.126波长λ/nm540560580600吸光度A1.0980.7880.2430.046纯碱式在不同波长下的吸光度波长λ/nm380390400405410415420吸光度A0.3510.4150.4600.4750.4880.4950.500波长λ/nm425430435440445450455吸光度A0.5030.5030.5010.4970.4910.4790.464波长λ/nm460480500520540560580吸光度A0.4400.3010.1480.0600.0280.0200.0142.验证朗伯比尔定律分别将用5.00ml10.00ml15.00ml20.00mla溶液的试剂标号为1,2,3,4;将用5.00ml10.00ml15.00ml20.00mlb溶液的试剂标号为5,6,7,8。测定该溶液在520nm,428nm波长下的吸光度。编号A520A42810.2430.02120.5010.05330.7470.07740.9860.10350.0100.10060.0260.20670.0370.30680.0510.407
【数据处理】1.根据实验步骤2测得的数据作A-λ图,绘制溶液a和溶液b的吸收光谱曲线,求出最大吸收峰的波长λa和λb。由上图可看出,a溶液的最高吸收峰约在520nm-525nm之间,b溶液的最高吸收峰约在425nm-430nm之间。
2.实验步骤3中得到四组A-C关系图,从图上可求得单组分溶液a和溶液b在波长各为λa和λb时的四个吸光系数。由图可知,两溶液的吸光度和其相应溶液浓度的线性关系很好,对几条直线进行线性拟合后,由斜率可得到HMR,MR在不同波长下的吸光系数:=1.2375,=0.135,=0.067,=0.5105.分别为波长在520nm和428nm时,甲基红酸式和碱式的吸光系数。
【结果与讨论】在对甲基红纯酸式和纯碱式溶液最高吸收峰的测定实验中,分析两个吸收曲线,可得到以下信息:对于纯酸式的甲基红溶液(A溶液),其图像符合单组分溶液吸光度曲线。在波长较小的范围内,吸光度较小,且吸光度变化幅度也较小。在420nm-430nm开始,吸光度开始很快的增长,直至在约520nm处增加幅度变缓,吸光度趋近最大值。此处即为纯酸式甲基红溶液的最高吸收峰。在继续增大波长,吸光度迅速变小。整个图形呈山峰状,有明显的最高吸收峰。并未对曲线进行高斯拟合,整个曲线没有出现很大的波折。但在560nm附近,可能由于读数不准确,导致此段曲线不甚平滑。由图上可以清楚的看出,甲基红酸性溶液最高吸收峰在520nm附近。对于纯酸式的甲基红溶液(B溶液),其图像符合单组分溶液吸光度曲线的后半部分。在测量起点即有较大的吸光度,继续增大波长,吸光度仍然增加。直至波长为425-430nm范围时,吸光度达到最大。再继续增大波长,吸光度开始变小。由于在吸收峰附近取点较多,在此图上可以清晰的看出吸光度的变化趋势。图形在425-430nm处有最大值,即甲基红纯碱式溶液的最高吸收峰在425nm-430nm之间。在验证朗伯比尔定律的实验过程中,配置了不同浓度的甲基红酸式溶液和碱式溶液,并对这些不同浓度的溶液进行吸光度检测。将吸光度对浓度作图,可以得到四条近似直线,对这些直线进行线性拟合,发现拟合度良好,R值在0.995以上,拟合线与原直线基本重合。根据朗伯比尔定律可知,当溶液长度一定的时候,吸光度与溶液浓度呈线性关系。而根据实验图的线性关系,可知本实验能够验证朗伯比尔定律。【思考】1.为什么每改变一次波长都要用空白溶液校准仪器?答:改变波长时,光源的光强等性质也会发生相应的改变,这些变化会造成与不同的背景,进而对样品吸光度数值有影响。为了消除背景影响,在改变波长时就需要重新用空白溶液校准仪器,以减小误差。2.怎样用可见光分光光度法对样品进行定性和定量分析?
答:利用分光光度法进行试样的检测,将试样光谱和估计的物质光谱进行比较,便可定性的鉴定试样所含成分;而由于吸收强度与物质浓度有精确的比例关系,因而可进行统一溶液集中成分的各自分析,或者进行高精度的定量分析。3.朗伯-比耳定律有什么适用范围?为什么?(1)入射光为平行单色光且垂直照射:非单色光经过样品后,非特定波长的光被吸收的很少,进入检测器,由光信号转为电信号,得出数据,如果仪器的光谱带宽过大会使定律不成立。大部分仪器所采用的光源都是发散式的,需经过透镜或凹面镜聚焦,绝大部分仪器经过样品池时都不是平行的,这样会引起光的复杂变化,使读数不准确,定律不成立。(2)吸光物质为均匀非散射体系:朗伯-比尔定律是适用于均匀、非散射的溶液的一般规律,如果被测试液不均匀,是胶体溶液、乳浊液或悬浮液,则入射光通过溶液后,除了一部分被试液吸收,还会有反射、散射使光损失,导致透光率减小,使透射比减小,使实际测量吸光度增大,使标准曲线偏离直线向吸光度轴弯曲,造成对朗伯-比尔定律的偏离。(3)吸光质点之间无相互作用.:因为质点在测试容器中会不停的运动,因为悬浊液或混浊液的质点体积比较大,会直接影响测试结果的不稳定,当质点运动到光射的位置会使透过率变小、吸光度变大,无法读出一个准确的值,自然使定律不成立。(4)辐射与物质之间的作用仅限于光吸收,无荧光和光化学现象发生.在被测溶液中待测组分发发生解离、缔合、光化等作用,或与溶剂相互作都将使待测组分的吸收曲线发生明显的改变,如吸收峰的形状、位置、强度以及精密结构都会发生变化,从而导致偏离朗伯一比尔定律。某些物质吸收光后能再新辐射出波长和入射光波长相近的荧光而导致定律失效。4.试解释甲基红的酸性溶液的吸收光谱为什么比其碱性溶液的吸收光谱红移?答:由甲基红的酸碱构型转换可知:甲基红在酸式构型中存在一种有较多重键共轭效应的构型,而重键共轭对紫外-可见吸收光谱呈红移,有浓色效应。故甲基红酸性溶液较碱性溶液吸收光谱红移。5.若仪器和溶液一样,但不同的实验操作者得到某种程度上有差异的结果,原因何在?应该怎样做才能得到可靠的实验数据?
答:首先,仪器本身具有一定的误差范围;另外,不同实验者的操作习惯,也会对实验结果产生一定的影响,也会有一定的误差。因此,想要得到可靠的实验数据,应该由不同的实验者在不同的仪器上进行操作,得到多组大致相符的实验结果,才能说这一结果是可靠的。【实验注意事项】1)使用分光光度计时,为了延长光电管的寿命,在不进行测定时,应将暗室盖子打开。仪器连续使用时间不应超过2h,如使用时间长,则中途需间歇0.5h再使用。2)比色槽经过校正后,不能随意与另一套比色槽个别的交换,需经过校正后才能更换,否则将引入误差。【.讨论】1)分光光度法和分析中的比色法相比较有一系列优点,首先它的应用不局限于可见光区,可以扩大到紫外和红外区,所以对于一系列没有颜色的物质也可以应用。此外,也可以在同一样品中对两种以上的物质(不需要预先进行分离)同时进行测定。2)吸收光谱的方法在化学中得到广泛的应用和迅速发展,也是物理化学研究中的重要方法之一,例如用于测定平衡常数以及研究化学动力学中的反应速度和机理等,由于吸收光谱实际上是决定于物质内部结构和相互作用,因此对它的研究有助于了解溶液中分子结构及溶液中发生的各种相互作用(如络合,离解,氢键等性质)。'
您可能关注的文档
- 分光光度法在环境监测中的应用
- ep7.0原子吸收分光光度法-中文
- 分光光度法测定海水样品化学耗氧量的研究
- 紫外-可见分光光度法习题与答案
- 利用分光光度法同时测定混合染料中三种染色剂成分的初步研究
- 废气中硫酸雾的测定 铬酸钡分光光度法
- 紫外-可见分光光度法习题(答案与解析)
- 红外分光光度法测定粉尘中游离二氧化硅含量
- 紫外分光光度法检测饮料中防腐剂的实验方案[20121120][1]
- 分光光度法与血糖测定ppt课件
- GB∕T 35069-2018 焦炭 磷含量的测定 还原磷钼酸盐分光光度法
- 紫外可见分光光度法与分子荧光光度法的比较
- 光催化降解过程中苯酚的分光光度法测定
- 原子吸收分光光度法测定cu不确定度评估报告
- 第十章紫外-可见分光光度法习题答案-2012秋
- 分光光度法与血糖测定ppt培训课件
- 原子吸收分光光度法在矿石矿物研究中应用
- 药典-近红外分光光度法指导原则