- 4.14 MB
- 77页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'第十章
紫外可见分光光度法一、光的波粒二象性二、电磁波谱和各种光三、物质对光的吸收四、电子跃迁类型五、常用概念六、吸收带与结构关系第一节
紫外可见光度法基本原理2021/9/21
分光光度法:是基于被测物质对光的选择性吸收而建立的分析方法。应用对象:一般是能吸收UV-ViS的分子或某些特定离子本章重点:(1)光的波粒二象性(2)紫外可见分光光度法基本原理和概念(3)定性定量方法2021/9/21
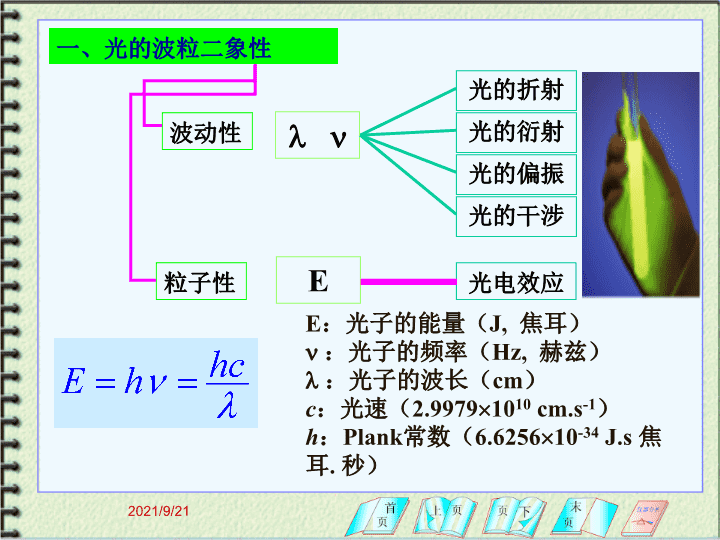
一、光的波粒二象性波动性粒子性E光的折射光的衍射光的偏振光的干涉光电效应E:光子的能量(J,焦耳):光子的频率(Hz,赫兹):光子的波长(cm)c:光速(2.99791010cm.s-1)h:Plank常数(6.625610-34J.s焦耳.秒)2021/9/21
二、电磁波谱和各种光射线x射线紫外光红外光微波无线电波10-2nm10nm102nm104nm0.1cm10cm103cm105cm可见光紫外可见光谱区为200~800nm其中紫外为200~400nm、可见为400~800nm在此区域主要是某些分子产生的吸收2021/9/21
单色光、复合光、光的互补单色光复合光光的互补单一波长的光由不同波长的光组合而成的光若两种不同颜色的单色光按一定的强度比例混合得到白光,那么就称这两种单色光为互补色光,这种现象称为光的互补。蓝黄紫红绿紫黄绿绿蓝橙红蓝绿2021/9/21
三、物质对光的吸收1、物质的颜色与光的关系完全吸收完全透过吸收黄色光光谱示意表观现象示意复合光吸收池黑色无色透明互补色2021/9/21
2、物质的吸收原理与光的关系光作用于物质时,物质吸收了相应波长的光,而显示出特征的颜色,这一过程与物质的性质及光的性质有关。物质对光的吸收具有选择性(量子化)物质对光的吸收满足Plank条件hS2S1S0S3E2E0E1E3hhh2021/9/21
物质的电子结构不同,所能吸收光的波长也不同,这就构成了物质对光的选择吸收基础。原子吸收是锐线光谱、分子吸收是带状光谱例:A物质B物质同理,得:1ev=1.610-19J.2021/9/21
3、物质吸收光谱(曲线)的类型测量某物质对不同波长单色光的吸收程度,以波长()为横坐标,吸光度(A)为纵坐标,绘制吸光度随波长的变化可得一曲线,此曲线即为吸收光谱。表示某物质吸收光谱的位置用λmax,表示物质吸收光谱的强弱用ε(吸光系数)250300350400nm1234λ2021/9/21
吸收光谱AbsorptionSpectrum原子内电子跃迁S2S1S0S3hE2E0E1E3S2S1S0Ahh分子内电子跃迁带状光谱锐线光谱A对光吸收程度对光吸收程度2021/9/21
吸收曲线的讨论:①同一种物质对不同波长光的吸光度不同。吸光度最大处对应的波长称为最大吸收波长λmax②不同浓度的同一种物质,其吸收曲线形状相似(如右图),且λmax值不变。而对于不同物质,它们的吸收曲线形状和λmax则不同。③吸收曲线可以提供物质的结构信息,并作为物质定性分析的依据之一。2021/9/21
④不同浓度的同一种物质,在某一定波长下吸光度A有差异,在λmax处吸光度A的差异最大。此特性可作为物质定量分析的依据。⑤在λmax处吸光度随浓度变化的幅度最大,所以测定最灵敏。吸收曲线是定量分析中选择入射光波长的重要依据。2021/9/21
1、有机化合物价电子类型有机化合物中存在三种价电子:σ电子、π电子、n电子它们对应有σ、σ*、π、π*及n轨道。如甲醛分子分子轨道理论:成键轨道—反键轨道。当外层价电子吸收紫外或可见辐射后,就从基态向激发态(反键轨道)跃迁。主要有四种跃迁,所需能量ΔΕ大小顺序为:n→π*<π→π*200nm。吸收强度较弱,又是检测不到。例:丙酮中羰基能产生该类跃迁,其λmax为279nmε为10-30。2021/9/21
(3)n→σ*跃迁所需能量较大。吸收波长多为150~250nm,大部分在远紫外区,而在近紫外区的仍不易观察到。含非键电子的饱和烃衍生物(含N、O、S和卤素等杂原子)均呈现n→σ*跃迁。如下表所示2021/9/21
(4)π→π*跃迁(最重要的跃迁)所需能量较小,吸收波长处于远紫外区的近紫外端或近紫外区,εmax一般在104L·mol-1·cm-1以上,属于强吸收。a.不饱和烃π→π*跃迁乙烯π→π*跃迁的λmax为165nm,εmax为1×104L·mol-1·cm-1,强吸收。b.共轭烯烃中的→*(HOMOLVMO)max165nm217nm₃₁₂2021/9/21
共轭烯烃中→*跃迁所需能量降低,因此,对应波长增大,同时也属于强吸收带如max=217nm,εmax为21000紫外光谱电子跃迁类型:n—π*跃迁π—π*跃迁饱和化合物无紫外吸收电子跃迁类型与分子结构及存在基团有密切联系根据分子结构→推测可能产生的电子跃迁类型;根据吸收谱带波长和电子跃迁类型→推测分子中可能存在的基团(分子结构鉴定)2021/9/21
1、吸收光谱:以波长为横坐标,以吸光度为纵坐标所描绘的曲线。2、吸收峰:曲线上吸光度最大的地方,对应的波长为max五、常用概念和术语3、生色团:最有用的紫外-可见光谱是由π→π*和n→π*跃迁产生的。这两种跃迁均要求有机物分子中含有不饱和基团。这类含有π键的不饱和基团称为生色团。简单的生色团由双键或叁键体系组成,如乙烯基、羰基、亚硝基、偶氮基—N=N—、乙炔基、腈基—CN等。2021/9/21
4、助色团:有一些含有n电子的基团(如—OH、—OR、—NH2、—NHR、—X等),它们本身没有生色功能(不能吸收λ>200nm的光),但当它们与生色团相连时,就会发生n—π共轭作用,增强生色团的生色能力(吸收波长向长波方向移动,且吸收强度增加),这样的基团称为助色团。5、红移与蓝移有机化合物的吸收光谱常常因引入取代基或改变溶剂使最大吸收波长λmax和吸收强度发生变化:λmax向长波方向移动称为红移,向短波方向移动称为蓝移(或紫移)。吸收强度即摩尔吸光系数ε增大或减小的现象分别称为增色效应或减色效应。2021/9/21
2021/9/21
六、吸收带与分子结构的关系电子跃迁类型与分子结构及其存在的基团有密切的联系,因此,可以根据分子结构来预测可能产生的电子跃迁,或者根据吸收谱带来推测分子的结构。例如:饱和烃只有σ→σ*跃迁;烯烃有σ→σ*跃迁也有π→π*跃迁;醛、酮同时存在σ→σ*、n→σ*、n→π*、π→π*四种跃迁而产生相应的吸收带。1、R吸收带(特殊基团带):由n→π*电子跃迁而产生的吸收带,是杂原子的不饱和基团这类生色团的特征。处于~300nm,是弱吸收,有时被掩盖。6、强带和弱带:在紫外可见光区内,凡是εmax值大于104的吸收峰为强带;小于102的吸收峰为弱带。2021/9/21
2、K吸收带(共轭作用)由于非环状共轭双键中的π→π*跃迁而产生的吸收带。该吸收带属于强吸收带。3、B吸收带(芳香族特征带)由于苯分子的振动和转动能级跃迁产生的吸收带。在230nm~270nm出现,属于较弱的吸收带,在蒸汽时出现精细结构(很多小锯齿峰),在极性溶液中精细结构消失,出现宽峰。4、E吸收带(芳香族特征带)由苯环中环状共轭系统的π→π*跃迁而产生的吸收带2021/9/21
该吸收带特点是产生两个紧相邻的E1(在180nm处)、E2(在200nm处)带,该吸收带均属于强吸收带。2021/9/21
第十一章
紫外可见分光光度法一、朗伯-比尔定律二、偏离吸收定律因素第二节
溶液吸收定律2021/9/21
一、朗伯-比尔定律1、透光率(透射比)Transmittance透光率定义:T取值为0.0%~100.0%全部吸收T=0.0%全部透射T=100.0%入射光I0透射光It2021/9/21
2、吸收定律的推导(简化)Lambert–BeerLawI0dbbItII-dIdI∝NIN:薄层中的吸光粒子数N=N0cdSdbN0:阿伏加德罗常数dS:捕获面积,薄层中被光照射的面积。c:吸光溶液的浓度N=k’cdb故dI∝NI=Ik’cdbdI=-Ikcdb,dI/I=-kcdb积分得或得2021/9/21
3、吸光度与透光率T:透光率A:吸光度1.00.50ACA100500T%TT=0.0%A=∞T=100.0%A=0.0A=0.434T=36.8%2021/9/21
4、吸光系数Absorptivityb:吸光液层的厚度,光程,cmc:吸光物质的浓度,g/L,mol/LK:比例常数入射光波长物质的性质温度取值与浓度的单位相关c:mol/LK摩尔吸光系数,L·mol–1·cm-1c:g/LKa质量吸光系数,L·g–1·cm-1c:g/100mLK比吸光系数相互关系溶剂2021/9/21
5、吸光度的加合性多组分体系中,如果各组分之间无相互作用,其吸光度具有加合性,即二、吸收定律偏离的因素标准曲线法测定未知溶液的浓度时,发现:标准曲线常发生弯曲(尤其当溶液浓度较高时),这种现象称为对朗伯—比耳定律的偏离。引起这种偏离的因素(两大类):(1)物理性因素,即仪器的非理想引起的;(2)化学性因素。2021/9/21
(1)物理性因素难以获得真正的纯单色光。朗—比耳定律的前提条件之一是入射光为单色光。分光光度计只能获得近乎单色的狭窄光带。复合光可导致对朗伯—比耳定律的正或负偏离。非单色光、杂散光、非平行入射光都会引起对朗伯—比耳定律的偏离,最主要的是非单色光作为入射光引起的偏离。2021/9/21
非单色光作为入射光引起的偏离假设由波长为λ1和λ2的两单色光组成的入射光通过浓度为c的溶液,则:A1=lg(Io1/It1)=ε1bcA2=lg(Io2/It2)=ε2bc故:式中:Io1、Io2分别为λ1、λ2的入射光强度;It1、It2分别为λ1、λ2的透射光强度;ε1、ε2分别为λ1、λ2的摩尔吸光系数;因实际上只能测总吸光度A总,并不能分别测得A1和A2,故2021/9/21
A总=lg(Io总/It总)=lg(Io1+Io2)/(It1+It2)=lg(Io1+Io2)/(Io110-ε1bc+Io210-ε2bc)令:ε1-ε2=;设:Io1=Io2A总=lg(2Io1)/It1(1+10-εbc)=A1+lg2-lg(1+10-εbc)讨论:因实际上只能测总吸光度A总,并不能分别测得A1和A2,故2021/9/21
讨论:A总=A1+lg2-lg(1+10-εbc)(1)=0;即:1=2=则:A总=lg(Io/It)=bc(2)≠0若<0;即2<1;-bc>0,lg(1+10bc)值随c值增大而增大,则标准曲线偏离直线向c轴弯曲,即负偏离;反之,则向A轴弯曲,即正偏离。2021/9/21
讨论:A总=A1+lg2-lg(1+10-εbc)(3)||很小时,即ε1≈ε2:可近似认为是单色光。在低浓度范围内,不发生偏离。若浓度较高,即使||很小,A总≠A1,且随着c值增大,A总与A1的差异愈大,在图上则表现为A—c曲线上部(高浓度区)弯曲愈严重。故朗伯—比耳定律只适用于稀溶液。(4)为克服非单色光引起的偏离,首先应选择比较好的单色器。此外还应将入射波长选定在待测物质的最大吸收波长且吸收曲线较平坦处。2021/9/21
(2)化学性因素朗—比耳定律的假定:所有的吸光质点之间不发生相互作用;假定只有在稀溶液(c<10-2mol/L)时才基本符合。当溶液浓度c>10-2mol/L时,吸光质点间可能发生缔合等相互作用,直接影响了对光的吸收。故:朗伯—比耳定律只适用于稀溶液。溶液中存在着离解、聚合、互变异构、配合物的形成等化学平衡时。使吸光质点的浓度发生变化,影响吸光度。例:铬酸盐或重铬酸盐溶液中存在下列平衡:CrO42-+2H+=Cr2O72-+H2O溶液中CrO42-、Cr2O72-的颜色不同,吸光性质也不相同。故此时溶液pH对测定有重要影响。2021/9/21
第十章
紫外可见分光光度法一、基本组成二、分光光度计的类型三、仪器测量误差四、实验技术及分析条件第三节
紫外—可见分光光度计2021/9/21
一、紫外-可见分光光度计组成0.575光源单色器吸收池检测器显示I0It参比样品入射光I0透射光It请注意与定义比较未考虑吸收池和溶剂对光子的作用2021/9/21
(1)光源在整个紫外光区或可见光谱区可以发射出连续光谱,要求:具有足够的辐射强度、较好的稳定性、较长的使用寿命。可见光区:钨灯作光源,其辐射波长范围在320~2500nm。紫外区:氢、氘灯。发射185~400nm的连续光谱。(2)单色器将光源发射的复合光分解成单色光并从中选出需要的波长①入射狭缝:光源的光由此进入单色器;②准光装置:透镜或返射镜使入射光成为平行光束;③色散元件:将复合光分解成单色光;棱镜或光栅;2021/9/21
④聚焦装置:透镜或凹面反射镜,将分光后所得单色光聚焦至出射狭缝;⑤出射狭缝。进入检测器(3)样品室样品室放置各种类型的吸收池(比色皿)和相应的池架附件。吸收池主要有石英池和玻璃池两种。在紫外区须采用石英池,可见区一般用玻璃池(为什么?)。2021/9/21
(4)检测器利用光电效应将透过吸收池的光信号变成可测的电信号,常用的有光电池、光电管或光电倍增管。(5)结果显示记录系统将信号放大并显示出来,由检流计、数字显示、微机等仪器组成。二、类型(1)单波长单光束分光光度计(2)单波长双光束分光光度计2021/9/21
(1)单波长单光束分光光度计0.575光源单色器吸收池检测器显示2021/9/21
(2)单波长双光束分光光度计比值光源单色器吸收池检测器显示光束分裂器2021/9/21
2021/9/21
2021/9/21
2021/9/21
2021/9/21
三、仪器测量误差根据误差传递公式,可以推导出浓度测量的相对误差为T=0.368=36.8%A=0.434为了减少测量误差,控制溶液的吸光度A=0.2~0.7T=70~10%0.3682021/9/21
四、实验条件选择1.仪器测量条件任何分光光度计都有一定的测量误差,这是由于光源不稳定、实验条件的偶然变动、读数不准确等因素造成的。这些因素对于试样的测定结果影响较大,特别是当试样浓度较大或较小时。因此,要选择适宜的吸光度范围,以使测量结果的误差尽量减小。通常将待测溶液的投射比(T)选在10%~70%或吸光度(A)在0.2~0.7即可。(如何实现?)2021/9/21
2、测量波长的选择无干扰,选择max有干扰,选择要根据干扰而定AA待测溶液吸光度的选择控制A=0.2~0.7T=70%~10%方法选择C(浓度)选择b(液层厚度)2021/9/21
3、参比液的选择原则:扣除非待测组分的吸收以显色反应为例进行讨论M+R=M-Rmax试液显色剂溶剂吸光物质参比液组成无吸收无吸收光学透明溶剂基质吸收无吸收吸收不加显色剂的试液无吸收吸收吸收显色剂基质吸收吸收吸收吸收显色剂+试液+待测组分的掩蔽剂若欲测M-R的吸收maxA(样)=A(待测吸光物质)+A(干扰)+A(池)A(参比)=A(干扰)+A(池)2021/9/21
4、显色反应有机物质官能团强吸收直接测定UV-VIS官能团弱吸收衍生化反应UV-VIS显色反应无机物质通常通过显色反应生成吸光系数大的有色物质进行测定,以提高灵敏度332+桔红色max邻二氮菲2021/9/21
(1)显色剂选择:a.显色反应灵敏度高,有较强的吸光能力;b.反应生成物组成恒定、稳定性好;c.对照性好,显色剂与有色配合物的λmax差别在60nm以上。(2)显色剂用量:通过实验确定。2021/9/21
第十章
紫外可见分光光度法一、定性、定量分析方法二、分光光度法应用三、有机物结构确定第四节紫外吸收光谱的应用2021/9/21
一、定性分析与定量分析法定性分析基础定量分析基础物质对光的选择吸收ABA在一定的实验条件下,物质对光的吸收与物质的浓度成正比。AC增大2021/9/21
1、定性方法定性主要的依据→吸收光谱所具有的以下特征吸收光谱的形状吸收峰的数目吸收峰的位置(波长)吸收峰的强度相应的吸光系数2021/9/21
2、定量方法类型<1>、单组分的定量吸光系数法(单色光很纯):在给定实验条件下由A=cb计算例如:维生素B12样品2.50mg用水溶解成100ml后,盛于1cm吸收池中,在361nm测得A值为0.507,求吸光系数和含量。已知吸光系数(比吸光系数)的标示量为E=207解:E=A/(cb)=0.507/0.0025=202.8g/100ml2021/9/21
样品中B12=E(样)/E(标)=202.8/207=98.0%标准曲线法(单色光不纯):依据A=kc测定时,配制一系列浓度不同的标准溶液,在同一条件下分别测定A,然后以A为纵坐标,浓度为横坐标绘制A-c曲线(标准曲线如右图)。根据样品溶液测得A值,从曲线上求得样品的浓度。该法对仪器要求不高,适合大批量样品分析Aci2021/9/21
芦丁含量测定0.710mg/25mL2021/9/21
对照法:在相同条件下,在线形范围内配制样品溶液和标准溶液,在选定波长处,分别测定吸光度。由朗伯-比尔定律求算。A样品=样品c样品b,A标=标c标b因同种物质,同台仪器,相同厚度吸收池及同一波长,故样=标,所以C样=(A样/A标)C标例如:维生素B12注射液含量测定:精密吸取B12注射液2.50ml,加水稀释至10.00ml摇匀。另配制B12标准液:精密称取B12标准品25.0mg,加水溶解并稀释至1000ml,摇匀。在361nm处,用1cm吸收池分别测得样品和标准溶液的A值为0.508和0.518,求B12注射液的浓度。2021/9/21
解:c样品=98.1μg/ml<2>、多组分定量多组分的定量依据:A总=Aa+Ab+Ac+…在混合组分测定中,遇到各组分吸收光谱双向重叠,相互干扰时,可根据测定目的、要求和光谱重叠的不同情况采用下列方法:三种情况:两组分吸收光谱不重叠(互不干扰)两组分在各自λmax下不重叠→分别按单组分定量2021/9/21
两组分吸收光谱部分重叠λ1→测A1→b组分不干扰→可按单组分定量测Ca(如下图)λ2→测A2→a组分干扰→不能按单组分定量测Ca(如下图)2021/9/21
2021/9/21
两组分吸收光谱完全重叠——混合样品测定a.解线性方程组法b.等吸收双波长消去法c.系数倍率法2021/9/21
a.解线性方程组法步骤:2021/9/21
b.等吸收双波长法步骤:消除a的影响测b2021/9/21
消去b的影响测a注:须满足两个基本条件选定的两个波长下干扰组分具有等吸收点选定的两个波长下待测物的吸光度差值应足够大2021/9/21
c.系数倍率法前提:干扰组分b不成峰形无等吸收点2021/9/21
步骤:b曲线上任找一点→λ1另一点为→λ2优点:同时将待测组分和干扰组分放大信号K倍,提高了待测组分测定灵敏度abλ1λ22021/9/21
二、紫外可见分光光度法应用实例1、氢键强度测定:氢键的形成能使羰基的n→π*跃迁吸收带发生紫移,例如丙酮在非极性溶剂己烷中n→π*跃迁的吸收波长为279nm,而在极性溶剂水中n→π*跃迁的吸收波长为264.5nm,两者跃迁的能量差正好是丙酮在水中形成氢键的强度。氢键的强度用EH表示。EH=EP-En=NAhc[(1/λp)-(1/λn)]p--代表在极性溶剂中;n--代表在非极性溶剂中NA--代表阿伏伽德罗常数;h--代表普朗克常数;c-光速上述丙酮在水中的氢键为EH=23.6KJ/mol2021/9/21
2、配合物的组成及稳定常数的测定(1)摩尔比法测配合比(饱和法)M+nR=MRn若M和R均不干扰MRn吸收CM固定CR从0开始增大,得到一系列CR/CM值不同溶液,在同一波长下测定溶液的A,然后作A对CR/CM图R=0,M=0,MRn>0ACR/CMn2021/9/21
(2)、条件稳定常数的测定00.51.0ACM/CA′A′pKa+1C=[R-]代入,得可推出作图,直线截距为pKapH,再由[HR]+[R-]=CpKa2021/9/21
例:浓度为2.0×10-4mol•L-1的甲基橙溶液,在不同pH值缓冲溶液中,于520nm波长下用1cm吸收池测得下列数据。pH0.881.172.993.413.954.895.50
A0.8900.8900.6920.5520.3850.2600.260计算甲基橙的Ka值。
解pH<1.17时,AHIn=εHIn•CHIn(1)pH>4.89时,AIn-=εIn-•CIn-(2)1.17pKa+1C=[R-]pH=pKa[HR]/[R-]=1A2A1测得A2测得A1A′对应的pH即为pKaA′pKa2021/9/21
目视比色法标准系列未知样品特点利用自然光比较吸收光的互补色光准确度低(半定量)不可分辨多组分方法简便,灵敏度高2021/9/21'
您可能关注的文档
- 邻二氮菲分光光度法测定微量铁.doc
- 实验_紫外分光光度法测定蛋白质含量.ppt
- 仪器分析 第5章 红外分光光度法.ppt
- 第11章紫外分光光度法3.ppt
- 火焰原子吸收分光光度法测定.ppt
- 实验报告中山大学火焰原子吸收分光光度法测定样品中的铜.doc
- 通则0401紫外-可见分光光度法.docx
- 火焰原子吸收分光光度法测定.ppt
- 第十三章 紫外可见分光光度法(定稿).ppt
- 仪器分析 第04章红外分光光度法.ppt
- 紫外分光光度法测定蛋白质含量.ppt
- 分光光度法基本原理.ppt
- 紫外可见光分光光度法(教学课件).ppt
- 关于黄丰明等的论文淡水磷监测中钼酸铵分光光度法的改进的撤稿声明.pdf
- 用双波长分光光度法测定排放废水中的痕量铀.pdf
- 双波长分光光度法测定.ppt
- 邻二氮菲分光光度法测定微量铁.ppt
- 原子吸收分光光度法.ppt