- 936.50 KB
- 44页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'第七章紫外与可见分光光度法第一节概述第二节紫外吸收光谱第三节光的吸收定律第四节紫外-可见分光光度计第五节显色反应及显色条件的选择第六节吸光度测量条件的选择第七节分光光度法的应用
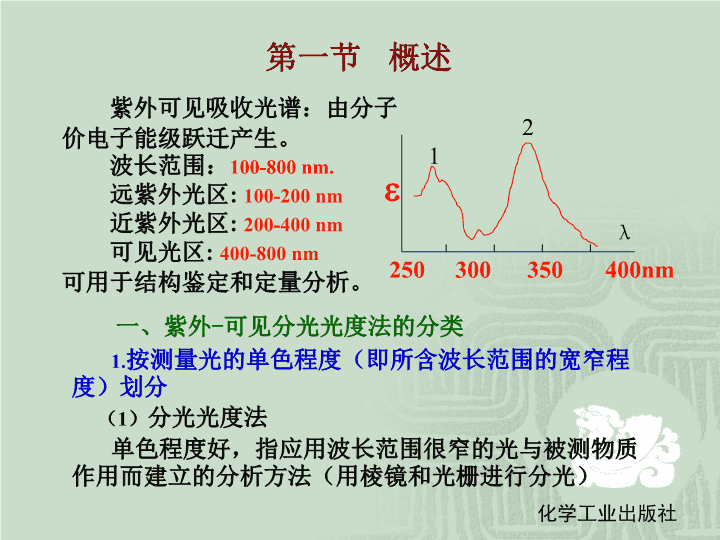
第一节概述一、紫外-可见分光光度法的分类1.按测量光的单色程度(即所含波长范围的宽窄程度)划分(1)分光光度法单色程度好,指应用波长范围很窄的光与被测物质作用而建立的分析方法(用棱镜和光栅进行分光)紫外可见吸收光谱:由分子价电子能级跃迁产生。波长范围:100-800nm.远紫外光区:100-200nm近紫外光区:200-400nm可见光区:400-800nm可用于结构鉴定和定量分析。250300350400nm12eλ
(2)比色法应用单色性较差的光(即包含相当宽的波长范围的光)与被测物质作用而建立的方法,仅在可见光区使用(400-780nm),包括目视法和光电比色法。2.按测量光所在的波谱区域划分(1)紫外分光光度法用于分析具有芳香结构及含有共轭体系的化合物。(2)可见分光光度法通常合称为紫外-可见分光光度法。
二、物质对光的选择性吸收溶液呈现的颜色是透过光的颜色,如左图所示,也就是物质所吸收光的互补色。三、UV-VIS法特点灵敏度高选择性好应用范围广设备和操作简单价格低廉
第二节紫外吸收光谱一、紫外吸收光谱的产生由分子中价电子能级的跃迁而产生。有机化合物分子的价电子主要有:形成单键的σ电子,形成双键的π电子,未成键的n(p)电子。当吸收一定能量后,这些价电子将跃迁到能量较高的能级,形成紫外吸收光谱。
可能发生的跃迁种类:(1)成键轨道与反键轨道之间的跃迁包括σ→σ*,π→π*(2)非键电子向反键轨道跃迁包括n→σ*,n→π*(3)电荷转移跃迁所需能量大小:σ→σ*>n→σ*>π→π*>n→π*二、无机化合物的紫外吸收光谱(1)荷移光谱①L→M②M→LE原子轨道反键分子轨道成键分子轨道ΔE
③M→M’(2)配位场光谱包括f→f和d→d跃迁三、有机化合物的紫外吸收光谱(一)紫外吸收光谱与有机化合物分子结构的关系生色团:分子中能吸收UV光的基团。它们含有π键和n电子,可发生n→π*和π→π*跃迁。如:C=C,C=O,S=C,C=N,N=N及N=O等。
助色团:能使生色团的吸收峰向长波方向移动的基团。这些基团都含有孤对电子,借助p-π共轭,使体系能量降低,使吸收峰移向长波。如:-OH,-Cl,-Br等。红移蓝移增色效应减色效应红移:吸收峰向长波方向移动蓝移:吸收峰向短波方向移动增色:吸收强度增大减色:吸收强度减小
1.饱和烃σ→σ*通常波长小于200nm例如,CH4σ→σ*125-135nmCH3Iσ→σ*150-210nmn→σ*259nm2.不饱和脂肪烃π→π*(1)含孤立双键、叁键的吸收峰位于远紫外光区。(2)若双键上有助色团取代,向长波方向移动。(3)若烯烃中含有两个或两个以上双键,但不共轭,其吸收峰的位置与孤立的C=C双键基本一致,但前者吸收强度增大。
(4)若烯烃中含有两个或两个以上双键共轭时,其吸收峰波长增加,吸收强度增大。这种由共轭双键中π→π*跃迁所产生的吸收带称为K带。由n→π*跃迁所产生的吸收带称为R带。
3.芳香烃芳香烃为环状共轭体系。苯在紫外光区有三个吸收带,它们都是由共轭的π→π*跃迁产生。E1带:185nm,摩尔吸光系数68000E2带:204nm,摩尔吸光系数8800B带:254nm,摩尔吸光系数200苯环有取代基时,峰的位置发生红移。稠环化合物,峰位红移得更明显。
(二)影响紫外吸收光谱的因素1.溶剂的影响(1)溶剂的极性①溶剂极性的影响ΔEnΔEpΔEnΔEp极性非极性极性非极性极性溶剂致使n→π*跃迁发生蓝移,使π→π*跃迁带发生红移。
互变异构极性溶剂非极性溶剂Λmax=204nmΛmax=243nm
②溶剂pH的影响E2210.5nm235nmB270nm287nm230nm203nm280nm254nm(2)分子结构的影响①共轭体系的影响②构型的影响③构象的影响
立体效应顺反异构空间位阻发生红移
(3)影响吸收峰强度的因素①电子从基态跃迁到激发态的几率②跃迁过程中偶极矩的变化(三)吸收波长计算的经验规则1.Woodward定则适用于计算共轭二烯,共轭多烯,共轭烯酮类化合物π→π*跃迁(K带)的吸收峰波长。
max=母体二烯烃+环外双键+延伸双键+共轭体系上取代烷基+共轭体系上取代的助色基共轭二烯基本值217nm同环二烯基本值253nm异环二烯基本值214nm增加一个共轭双键30nm环外双键5nm烷基或环残余取代5nm烷氧基取代–OR6nm含硫基团取代–SR30nm胺基取代–NR260nm卤素取代5nm酰基取代–OCOR0nm
不饱和羰基化合物π→π*跃迁λmax的计算方法λ(nm)α、β不饱和羰基化合物(无环、六员环或较大的环酮)基本值215α、β键在五员环内202当x为H时209当x为OH或OR时193增加一个共轭双键30增加同环二烯39环外双键、五员环及七员环内双键5烯基上取代:αβγδ烷基-R10121818烷氧基-OR35301731羟基-OH35305050酰基-OCOR6666-Cl15121212-Br25302525-SR80-NR295
已知某化合物的λmax=286nm,确定其结构。基本值:215nm215nm烷基取代β:12nm0nmγ:0nm18nmδ:18nm18nm环外双键:5nm5nm共轭系统延长:30nm30nmλmax=280nmλmax=286nm
2.Scott定则Y=烷基或环残基基本值为246nmY=H基本值为250nmY=OH,OR基本值为230nm取代基X分邻位,间位与对位取代基邻位间位对位取代基邻位间位对位R(烷基)3310Br2215OH,OR7725NH2131358O112078NHAc202045Cl0010NR2202085
(四)紫外分光光度法的应用1.定性分析2.推测有机化合物的结构①推测化合物的共轭体系♣200-400nm无吸收,无共轭体系♣210-250nm强吸收,K带,有两个双键共轭♣260-350nm强吸收,K带,3到5个双键共轭♣270-350nm弱吸收,R带,分子中含有羰基♣250-300nm中等强度吸收,含有苯环
②区分化合物的构型和构象③互变异构体的测定式中,En、λN为在非极性溶剂中跃迁的能量和波长;Ep和λp为在极性溶剂中跃迁的能量和波长;N为阿佛加德罗常数;h为普朗克常数;c为光速。3.氢键强度的测定4.鉴定有机化合物的纯度
第三节光的吸收定律一、Lambert-Beer定律前提:单色光方法:用选定波长的光照射被测物质溶液,测量它的吸收度A-吸光度;I-透过光的强度;I0-入射光的强度;k-比例系数;b-比色皿的厚度;c-溶液的浓度T=A=0≤A≤∞;0≤T≤1T-透光率;A=kcb
二、比例系数k的意义及表示方法A=kcbk=A/cbk表示单位浓度,单位液层厚度的吸光度,它与吸光物质的性质及入射光的波长有关。k的表示方法依赖于溶液浓度的表示方法,当b的单位为cm时,k有以下3种表示方法。①c的单位为g/L,k称为吸收系数,以a表示,单位为L·g-1·cm-1。②c的单位为mol/L,k称为摩尔吸光系数,以ε表示,单位为L·mol-1·cm-1。③c的单位为百分浓度,k称为百分吸收系数,以表示。
三、吸光度的加和性四、偏离比尔定律的原因1.入射光非单色性引起的偏离为讨论方便,假设入射光仅由波长λ1和λ2组成,对于λ1,吸光度为A′,则,ε1bc1+ε2bc2+…+εnbcn
对于λ2,吸光度为A〞,则,测定时,入射光总强度为(),透过光强度为(),因此,实际测得的吸光度值为
2.溶液本身引起的偏离化学因素:要求络合物组成一定且稳定存在溶液折射率变化溶液散射当时,则A与c不成直线关系;其差别越大,A与c间线性关系的偏离也越大。当时,A=εbc,A与c成直线关系;
光度计一、仪器的分类光电比色计(VIS)UV-VIS分光光度计按波长双光束UV-VIS计单光束UV-VIS计按光束单波长UV-VIS计双波长UV-VIS计第四节紫外-可见分光光度计
1.光源UV-氢灯、氘灯、汞灯VIS-钨丝灯、碘钨灯2.单色器滤光片:其颜色应与溶液颜色互为补色棱镜:玻璃棱镜、石英棱镜光栅:平面或凹面反射光栅3.吸收池石英吸收池-UV光区玻璃吸收池-VIS光区4.检测系统:光电池、光电管、光电倍增管5.读数显示系统检流计、自动记录型和数字显示性装置二、仪器基本结构
第五节显色反应及显色条件的选择一、显色反应的选择1.无机显色剂硫氰酸盐、钼酸胺、过氧化氢等2.有机显色剂偶氮类、三苯甲烷类、卟啉类、安替比林类、杂多酸类等灵敏度高,选择性好,显色剂在测定波长处无明显吸收,有色化合物组成恒定、稳定性好。二、显色剂
二、显色条件的选择1.显色剂用量的选择则:上式左边的比值越大,说明反应越完全,显然k大、显色剂用量大,利于生成有色络合物。显色剂用量的确定:CM及其它条件固定,改变CL,测其吸光度,绘制吸光度与CL关系曲线。
确定方法:固定待测组分及显色剂浓度,改变溶液的pH值,测定吸光度,绘制A-pH曲线。3.显色温度2.溶液的酸度
4.显色时间确定方法:配置一份显色溶液,每隔一定时间测一次A,绘制A-t曲线。5.干扰离子的影响及相除(1)干扰离子的影响与显色剂生成有色配合物,产生正误差;干扰离子本身有颜色,产生正误差;与被测离子反应,产生负误差。(2)消除干扰的方法①控制溶液的酸度②加入掩蔽剂③分离干扰离子④选择适当测量波长及参比溶液
一、入射波长的选择二、参比溶液的选择(1)显色剂及其它试剂均无色,可用纯溶剂做参比溶液。(2)显色剂或其它试剂有色,可用空白溶液作参比溶液。(3)显色剂无色,而试样有色,可用试样作为参比溶液。第六节吸光度测量条件的选择原则没有干扰,选择λmax为测定波长;有干扰时,可选择非λmax为测定波长。
三、吸光度读数范围的选择在不同吸光度范围内读数会引起不同程度的误差,最适宜的读数范围为0.2-0.8之间。对于一个给定的光度计,透光率读数误差是一个常数,约为±0.2%-±2%,但透光率读数误差不能代替测定结果误差,测定结果误差常用浓度的相对误差Δc/c表示。A=kcbΔA=kbΔcΔc/c=ΔA/A
假设ΔT=0.5%,可算出不同T时的Δc/c值。A=0.434或T=36.8%时,浓度测量误差最小,约为1.4%;A=0.15-1.0或T=70%-10%范围内,浓度测量误差约为1.4%-2.2%。
第七节分光光度法的应用一、单一组分的测定例如,邻二氮菲法测Fe2+,在pH3-8,形成橙红色配合物,λmax=512nm,ε=1.1×104二、高含量组分的测定需采用示差法,即用比试液浓度(Cx)稍低的标准溶液(Cs)作参比,调节仪器的透光率为100%(A=0),然后测定试液的吸光度(Ar,称为相对吸光度);若用普通法,以空白为参比,可测得试液与标准溶液的吸光度分别为Ax和As,根据Beer定律:
Ax=εbcxAs=εbcsAr=Ax–As=εb(cx-cs)=εbΔccx=Δc+cs普通法,浓度相对误差的计算:示差法,浓度相对误差的计算:式中,Tr为试样相对于标准溶液为参比时测得的透光率,Ts为标准溶液在普通法测得的透光率。
三、多组分分析1.吸收光谱不重叠2.吸收光谱重叠在波长λ1和λ2处测定吸光度A1和A2,由吸光度的加和性,可得式中,cx和cy分别为x和y的浓度。
四、光度滴定通过测定待测液吸光度的变化以确定反应终点的方法,称为光度滴定法。这种方法是将盛有待测溶液的滴定池放入分光光度计的光路中,测定滴定过程中溶液的吸光度,并绘制滴定体积和对应的吸光度曲线,根据滴定曲线就可以确定滴定终点。五、络合物组成及稳定常数的测定摩尔比法:设金属离子M与络合剂L的反应为
固定CM,增加CR,并测定一系列MRn的吸光度A,以CR/CM比值对A作图,得如图所示曲线。其中,曲线拐点处对应的值为配合比n。
稳定常数:在曲线上任取一点Ai:
于是,可得K六、双波长分光光度法等吸收法:'
您可能关注的文档
- COD快速消解分光光度法.doc
- 原子吸收光谱法或原子吸收分光光度法.ppt
- 分析化学第13章原子吸收分光光度法.pdf
- 邻菲罗啉分光光度法测定溶液中的铁离子.pdf
- 水质化学需氧量的测定快速消解分光光度法.doc
- 可见分光光度法测定微量铁.doc
- 紫外可见分光光度法测定维生素B.doc
- HJ1051-2019土壤 石油类的测定 红外分光光度法.pdf
- 仪器分析 第三版课件 教学课件 作者 黄一石 吴朝华 杨小林 编 子模块2:紫外-可见分光光度法任务5:紫外分光光度法的应用.ppt
- 仪器分析 第三版课件 教学课件 作者 黄一石 吴朝华 杨小林 编 子模块4:原子吸收分光光度法任务5:原子吸收基本原理.ppt
- 无机及分析化学 教学课件 作者 王永丽 李忠军 伍伟杰 主编 无机及分析上交课件第十一章 紫外-可见分光光度法新.ppt
- 分光光度法研究习题(.doc
- 药用基础化学 第二版课件 教学课件 作者 戴静波 主编 第八章 光谱分析法分光光度法.ppt
- 空气中甲醛检测方法-----酚试剂分光光度法.doc
- 分光光度法测定高锰酸钾溶液的含量.doc
- 分光光度法及分光光度计使用方法.ppt
- 紫外分光光度法标准操作规程.doc
- 纳氏试剂分光光度法测氨氮.ppt