- 287.58 KB
- 5页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'第42卷分析化学(FENXIHUAXUE)研究报告第4期2014年4月ChineseJournalofAnalyticalChemistry542~546DOI:10.3724/SP.J.1096.2014.31084基于碳量子点荧光分光光度法检测叶酸邓小燕李佳渝谭克俊(发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆400715)摘要在pH7.3磷酸盐缓冲介质中,通过静电作用,叶酸能猝灭碳量子点在384am处的荧光。其猝灭的荧光信号强度与叶酸浓度呈一定线性关系,据此建立了检测叶酸的荧光分光光度法。线性范围为0.025—2.0~mol/L,相关系数为0.9947,检出限为2.5nmol/L。表征了体系的荧光光谱,吸收光谱及荧光寿命,探讨了体系的反应机理,优化了实验条件。本方法用于模拟血清中叶酸含量的检测,加标回收率为97.3%一101.6%,RSD≤4.9%。关键词荧光分光光度法;叶酸;碳量子点1引言叶酸(Folicacid,FA)作为一种水溶性B族维生素,是细胞分裂、生长不可缺少的物质。所有生长发育或新陈代谢旺盛的组织也均需要有足够的叶酸_lJ。若叶酸不足,细胞的再生就会受到阻碍,引起巨幼红细胞贫血;此外,还会导致头发变灰、舌头发炎、肠胃不适、智力退化。而孕妇缺乏叶酸,可能引起胎儿宫内发育迟缓、早产和低体重出生等。叶酸在生命体中扮演着如此重要的角色,因此对叶酸的分析检测具有十分重要的意义。现有对叶酸的检测方法主要包括分光光度法J、微生物法J、等离子发射光谱法]、气相色谱法5]、高效液相色谱法等,在众多检测方法中,荧光分光光度法由于其简单、灵敏及成本低等优点,广泛用于体系中待测物质的分析检测"J。到目前为止,通过合成各种纳米材料(NPs)用于检测叶酸的报道并不多,其中Geszke等合成了水溶性的Mn:ZnS/ZnS量子点(QDs),基于FA与QDs作用导致其荧光强度降低实现了叶酸含量的测定;Gudarzy等报道了基于Y:O,:Eu纳米材料来检测叶酸;Liu等。。合成了水溶性的CulnS量子点,基于荧光猝灭.恢复实现对叶酸含量测定。近年来,碳量子点(Carbonquantumdots,CQDs)作为一种新型荧光纳米材料受到越来越多的关注。由于其具有荧光强度高、光稳定性好、耐光漂白、低毒性、生物相容性好¨等优点广泛应用于各个分析领域。本研究合成了一种水溶性好,荧光强度高,耐光漂白的CQDs_l,探讨了CQDs与FA的相互作用关系。研究发现,FA能使CQDs的荧光猝灭,其猝灭程度与FA的浓度具有一定的线性关系,据此建立了检测FA的荧光分光光度法。本方法简单,快速,灵敏度高。2实验部分2.1仪器与试剂F-2500荧光分光光度计(日本13立公司),U-3010紫外.可见分光光度计(日本日立公司),25mL对位聚苯(Polyphenyl,PPL)水热反应釜(上海岩征实验仪器有限公司),电热恒温鼓风干燥箱(上海精宏实验设备有限公司);H1650.W台式微量高速离心机(湖南湘仪实验室仪器开发有限公司),ZEN-3690电位分析仪(马尔文仪器有限公司)。叶酸储备液:准确称取叶酸标准品(成都市科龙化工试剂厂)22.1mg,用超纯水溶解并定容至250mL,得到2.0xl0mol/L叶酸储备液。0.2mol/LNaH2PO4一Na2HPO4缓冲溶液(PBS);30%H202、NaOH、甲醇(重庆川东化工(集团)有限公司);十六烷基三甲基溴化铵(CTAB,国药集团化学试剂有限公司);C印(阿拉丁,纯度>99.9%)。试剂均为分析纯,实验用水为超纯水。2013-08-23收稿;2013—12-27接受本文系国家自然科学基金项目(No.21377103)资助E—mail:tankj@swu.edu.cn
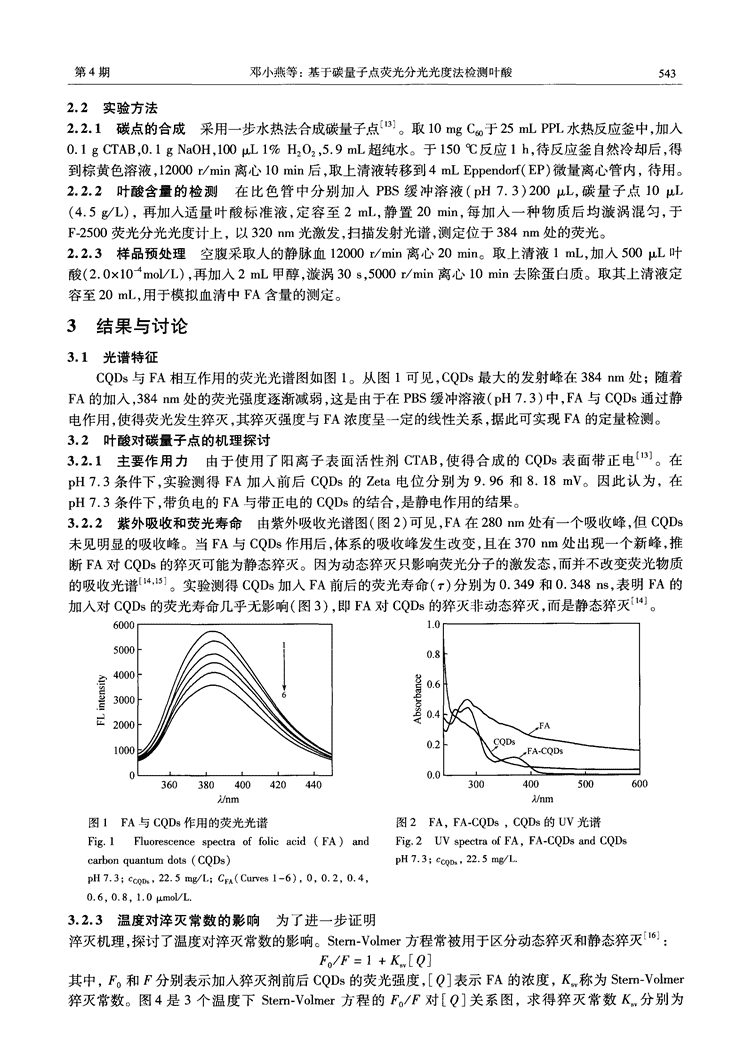
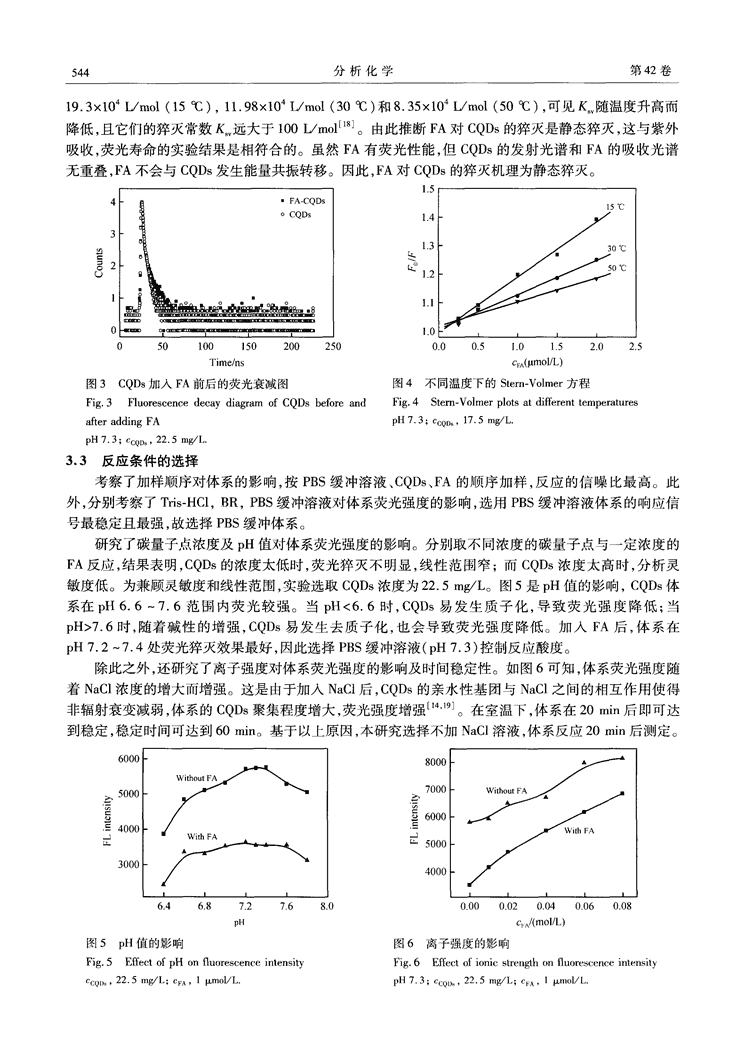
第4期邓小燕等:基于碳量子点荧光分光光度法检测叶酸5432.2实验方法2.2.1碳点的合成采用一步水热法合成碳量子点13]。取10mgC∞于25mLPPL水热反应釜中,加入0.1gCTAB,0.1gNaOH,1001%H202,5.9mL超纯水。于150oC反应1h,待反应釜自然冷却后,得到棕黄色溶液,12000r/min离心10min后,取上清液转移到4mLEppendof(EP)微量离心管内,待用。2.2.2叶酸含量的检测在比色管中分别加入PBS缓冲溶液(pH7.3)200/xL,碳量子点lO(4.5L),再加入适量叶酸标准液,定容至2mL,静置20rain,每加入一种物质后均漩涡混匀,于F-2500荧光分光光度计上,以320nm光激发,扫描发射光谱,测定位于384nm处的荧光。2.2.3样品预处理空腹采取人的静脉血12000r/min离心20rain。取上清液1mL,加入500IxL叶酸(2.0×104moL/L),再加入2mL甲醇,漩涡30s,5000r/min离心10min去除蛋白质。取其上清液定容至20mL,用于模拟血清中FA含量的测定。3结果与讨论3.1光谱特征CQDs与FA相互作用的荧光光谱图如图1。从图1可见,CQDs最大的发射峰在384nm处;随着FA的加入,384nm处的荧光强度逐渐减弱,这是由于在PBS缓冲溶液(pH7.3)中,FA与CQDs通过静电作用,使得荧光发生猝灭,其猝灭强度与FA浓度呈一定的线性关系,据此可实现FA的定量检测。3.2叶酸对碳量子点的机理探讨3.2.1主要作用力由于使用了阳离子表面活性剂CTAB,使得合成的CQDs表面带正电¨。在pH7.3条件下,实验测得FA加入前后CQDs的Zeta电位分别为9.96和8.18mV。因此认为,在pH7.3条件下,带负电的FA与带正电的CQDs的结合,是静电作用的结果。3.2.2紫外吸收和荧光寿命由紫外吸收光谱图(图2)可见,FA在280Fin处有一个吸收峰,但CQDs未见明显的吸收峰。当FA与CQDs作用后,体系的吸收峰发生改变,且在370Fin处出现一个新峰,推断FA对CQDs的猝灭可能为静态猝灭。因为动态猝灭只影响荧光分子的激发态,而并不改变荧光物质的吸收光谱_1"]。实验测得CQDs加入FA前后的荧光寿命(.r)分别为0.349和0.348as,表明FA的加入对CQDs的荧光寿命几乎无影响(图3),即FA对CQDs的猝灭非动态猝灭,而是静态猝灭¨。图1FA与CQDs作用的荧光光谱图2FA,FA-CQDs,CQDs的uV光谱Fig.1Fluorescencespectraoffolicacid(FA)andFig.2UVspectraofFA.FA-CQDsandCQDsc~bonquantumdots(CQDs)pH7.3;CCQD,22.5mg/L.pH7.3;CCQD,22.5mg/L;CVA(Curves1—6),0,0.2,0.4,0.6,0.8,1.0Ixmol/L.3.2.3温度对淬灭常数的影响为了进一步证明淬灭机理,探讨了温度对淬灭常数的影响。Stern.Volmer方程常被用于区分动态猝灭和静态猝灭¨:/=1+[Q]其中,和F分别表示加人猝灭剂前后CQDs的荧光强度,[Q]表示FA的浓度,K称为Stern—Volmer猝灭常数。图4是3个温度下Stem.Volmer方程的/F对[Q]关系图,求得猝灭常数K分别为
544分析化学第42卷19.3x10L/tool(15qC),11.98x10L/tool(30℃)和8.35x10L/tool(50qC),可见K随温度升高而降低,且它们的猝灭常数远大于100L/tool。由此推断FA对CQDs的猝灭是静态猝灭,这与紫外吸收,荧光寿命的实验结果是相符合的。虽然FA有荧光性能,但CQDs的发射光谱和FA的吸收光谱无重叠,FA不会与CQDs发生能量共振转移。因此,FA对CQDs的猝灭机理为静态猝灭。图3CQDs加入FA前后的荧光衰减图图4不同温度下的Stern—Volmer方程Fig.3FluorescencedecaydiagramofCQDsbeforeandFig.4Stern—VolmerplotsatdifferenttemperaturesafteraddingFApH7·3;CCQD,17·5mg/L.pH7.3;CCQD,22.5mg/L.3.3反应条件的选择考察了加样顺序对体系的影响,按PBS缓冲溶液、CQDs、FA的顺序加样,反应的信噪比最高。此外,分别考察了Tris—HC1,BR,PBS缓冲溶液对体系荧光强度的影响,选用PBS缓冲溶液体系的响应信号最稳定且最强,故选择PBS缓冲体系。研究了碳量子点浓度及pH值对体系荧光强度的影响。分别取不同浓度的碳量子点与一定浓度的FA反应,结果表明,CQDs的浓度太低时,荧光猝灭不明显,线性范围窄;而CQDs浓度太高时,分析灵敏度低。为兼顾灵敏度和线性范围,实验选取CQDs浓度为22.5mg/L。图5是pH值的影响,CQDs体系在pH6.6~7.6范围内荧光较强。当pH<6.6时,CQDs易发生质子化,导致荧光强度降低;当pH>7.6时,随着碱性的增强,CQDs易发生去质子化,也会导致荧光强度降低。加入FA后,体系在pH7.2~7.4处荧光猝灭效果最好,因此选择PBS缓冲溶液(pH7.3)控制反应酸度。除此之外,还研究了离子强度对体系荧光强度的影响及时间稳定性。如图6可知,体系荧光强度随着NaC1浓度的增大而增强。这是由于加入NaC1后,CQDs的亲水性基团与NaC1之间的相互作用使得非辐射衰变减弱,体系的CQDs聚集程度增大,荧光强度增强_1’]。在室温下,体系在20min后即可达到稳定,稳定时间可达到60rain。基于以上原因,本研究选择不加NaC1溶液,体系反应20rain后测定。c~.f(mollL)图5pH值的影响图6离子强度的影响Fig.5EffectofpHonfluorescenceintensityFig.6EffectofionicstrengthonfluorescenceintensitycCQI),22.5mg/L;CFA,1Ixmol/L.pH7.3;cCQI),22.5rag/L;FA,1IxmolZL.
第4期邓小燕等:基于碳量子点荧光分光光度法检测叶酸5453.4分析参数在优化的实验条件下,不同浓度FA后的荧光光谱变化见图7。体系在384Bin处的荧光猝灭强度与FA浓度在0.025~2.0i~moL/L范围内呈线性关系,线性回归方程为一F=1793.2c(p~moL/L)+110.2,相关系数为0.9947,检出限为2.5nmol/L。3.5共存物质影响在优化的实验条件下,考察了常见糖类、氨基酸、无机盐等共存物质对体系的影响,结果见表1。实验发现,常见的糖类、氨基酸、无机盐对体系的影响较小,Fe对体系的干扰相对较大,但是不影响实际样品的测定。在最佳优化条件下,只有FA在该条件下有很好的响应。说明体系对FA的选择性好。3.6样品分析在优化的条件下,检测模拟血清样品中FA含图7CQDs与FA作用的荧光曲线图量,每个样品平行测定5次。通过标准加入法测定了Fig.7FluorescencecurveofCQDsupontheadditionof回收率和相对标准偏差,结果见表2,样品的回收率在differentconcentrationsofFA97.3%~101.6%之间,相对标准偏差小于4.9%。pH7.3;CCQD,22.5mg/L.表1共存物质影响Table1ToleranceofforeignsubstancesS共存物c。薏辇物c。i。雪ubstances“S一es“(~%rt-o)rK.(C1)7000.76苯丙氨酸Phenylalanine5.04.8Ca“,(C1一)300_JD.17酒石酸Tartaricacid7.54.3Mg,(C1)70-2.66抗坏血酸Ascorbicacid10.01.1Fe¨.(C1)13.74柠檬酸Citricacid7.5—1.2Ni.(Cr)751.14谷氨酸Glutamicacid5.0-4.9Co“,(sol一)702.16葡萄糖glucose7.50.3cr3,(sOj一)5.0-2.53蔗糖Sugar3.5_4.8Ba,(s0一)84.32丝氨酸Serine50.0—1.8Cu“.(C1)5-1.25环糊精Cyclodextrin7.02.7NO,(Na)102.61精氨酸Arginine5.01.8sol,(Na)500.96苏氨酸Threonine5.02.3亮氨酸Leucine5-4.2组氨酸Histidine7.00.27表2模拟血清样品分析结果及回收实验Table2AnalyticalresultsandrecoverytestsofFAinsimulatedhumanserumsamplesReferences1LucockM.Mo1.Genet.Metab.,2000,71(1.2):121—1382YELi,TIANYi·Mei.TianfinPhamacy,2000,12(3):63—64叶立,田义梅.天津医学,2000,12(3):63—643HAOLing,ZHENGJun—Chi,TIANYi—Hua,FANDa—Wei,LIZhu.JournalofPepekingUniversity(HealthSciences),2004,36(2):210—214郝玲,郑俊池,田熠华,范大伟,李竹.北京大学学报(医学),2004,36(2):210—214
分析化学第42卷4WANGWei,SUNWei—De.ChineseAna1.Chem.,2003,31(10):1280王伟,孙伟德.分析化学,2003,31(10):12805WENXiao—Qing,YANGYue—Xin.ChineseJournalofFoodHygiene,2004,16(1):65—70文小青,杨月欣.中国食品卫生杂志,2004,16(1):65—706LONGChao·Yang,GAOHong—Yan,XUXiu—Min,LIANGFu—Rong,LIANGChan—Hui.ChineseAna1.Chem.,2004,32(10):1341—1344龙朝阳,高艳红,许秀敏,梁富荣,梁春穗.分析化学,2004,32(10):1341—13447ZHOUFu—Lin,SONGShao—Fei,GONGQiao—Juan,ZHANGWen·Can,WANGTian—Jiao.JournalofInstrumentalAnalysis,2010,29(3):272-275周福林,宋少飞,弓巧娟,张稳婵,王天娇.分析测试学报,2010,29(3):272—2758GeszkeM,MuriasM,BalanL,MedjahdiG,KorczynskiJ,MoritzM,LulekJ,SchneiderR.Acta.Biomater.,2011,7(3):1327—13389GudarzyF,MoghaddamAB,MozafariS,GanjkhanlouY,KazemzadM,ZahedR,BaniF.Microchim.Acta.,2013,180(13—14):1257—126210LiuSY,HuJJ,SuXG.Analyst,2012,137:4598-460411YuSJ,KangMW,ChangHC,ChenKM,YuYC.Am.Chem.Soc.,2005,127(50):17604—1760512XuXY,RayR,GuYL,PloehnHJ,GearheartL,RakerK,ScrivensWA.Am.Chem.Soc.,2004,126(40):12736-1273713GaoMX,LiuCF,wuzL,ZengQL,YangXX,wuWB,¨YF,HuangCZ.Chem.Commun.,2013,49:8015—8017XUJin—Gou,WANGZun—Ben.FluorometricAnalysisMethod.Beijing:SciencePress,2006:64—70许金钩,王尊本.荧光分光法.北京:科学出版社,2006:64—7015LakowiczJR.New】‘9:Springer,2006:208-28216MopelolaI,EmmanuelL,TebelloN.Photochem.Photobio1.A,2008,198:7—1217YANGMan—Man,YANGPin,ZHANGLi—Wei.Chin.Sci.Bul1.,1994,39(1):31-35杨曼曼,杨频,张立伟.科学通报,1994,39(1):31—35JiaXF,LiJ,WangEK.Small,2013,9(22):3873—3879CarbonQuantumDots-BasedFluorescenceSpectrophotometricAssayofFolicAcidDENGXiao—Yan,LIJia—Yu,TANKe—Jun(EducationMinistryKeyLaboratoryonLuminescenceandReal—TimeAnalysis,CollegeofChemicalandChemistryEngineering,SouthwestUniversity,Chongqing400715,China)AbstractInNaH2PO4-Na2HPO4buffermedium(pH7.3),theelectrostaticinteractionoffolicacidwithcarbonquantumdotsresultsinthefluorescencequenchingofcarbonquantumdotscharacterizedat384nm.Experimentsshowedthatthequenchedfluorescenceintensitywasinproportionaltotheconcentrationoffolicacidcontentovertherangeof0.025-2.0p~mol/Lwithacorrelationcoeficientof0.9947.Therefore,asensitivefluorescencespectrophotometricmethodforthedeterminationoffolicacidwasdeveloped.Thelimitofdetection(LOD)was2.5nmol/L.Inthiswork,thefluorescencespectra,UV—Visspectraandfluorescencelifetimewerecharacterized.Thereactionmechanismandtheoptimumofreactionconditionwerealsoinvestigated.Themethodhasbeenappliedforthedeterminationoffolicacidinsimulatedserumwiththerecoveryfrom97.3%to101.6%andtheRSDlowerthan4.9%.KeywordsFluorescencespectrophotometry;Folicacid;Carbonquantumdots(Received23August2013;accepted27December2013)ThisworkwassupportedbytheNationalNaturalScienceFoundationofChinafNo.21377103)'
您可能关注的文档
- 铁矿石硅含量的测定 硫酸亚铁铵还原-硅钼蓝分光光度法,GB_T6730.9-2016.pdf
- 铁矿石氟含量的测定 镧-茜素络合腙分光光度法,GB_T6730.27-2017.pdf
- 铁矿石钒含量的测定 N-苯甲酰苯胲萃取分光光度法,GB_T6730.31-2017.pdf
- 碳四烯烃中微量羰基化合物含量的测定分光光度法,SH_T1493-2015.pdf
- 乙烯-丙烯共聚物(EPM)和乙烯-丙烯-二烯烃三元共聚物(EPDM)中钒的测定分光光度法,SH_T1814-2017.pdf
- 橡胶结合苯乙烯含量的测定 分光光度法,GB_T13646-2013.pdf
- 酚试剂分光光度法在室内甲醛检测中的实际应用.pdf
- 紫外-可见分光光度法习题与答案.doc
- 基于脉动变光程的分光光度法自标定检测磷酸盐.pdf
- 碱溶分光光度法测定植硅体碳含量.pdf
- 磺基水杨酸分光光度法测铁.doc
- 镧掺杂二氧化钛∕沸石微柱在线预富集-分光光度法测定溶菌酶含量.pdf
- 分光光度法测定地下水中六价铬的不确定度评定.pdf
- 现代化学化工分析方法与实验技术教学教案紫外-可见分光光度法.ppt
- 原子吸收法与分光光度法测煤灰中铁含量比对研究.pdf
- 硅钼黄分光光度法测定地下水中偏硅酸的不确定度评定.pdf
- 硅钼蓝分光光度法测定铬铁矿石中的二氧化硅.pdf
- 系数倍率双波长分光光度法同时测定钢样中的铝和铜的含量.pdf