- 255.93 KB
- 4页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'第39卷分析化学(FENXIHUAXUE)研究简报第1期2011年1月ChineseJournalofAnalyticalChemistry103~106DOI:10.3724/SP.J.1096.2011.00103镧掺杂二氧化钛/沸石微柱在线预富集一分光光度法测定溶菌酶含量田苗苗苏日艳贾琼鲍长利权新军(吉林大学化学学院,长春130022)摘要以镧掺杂二氧化钛/沸石吸附剂微柱为军取装置,建立溶菌酶的分光光度检测法。考察了,实验条件对萃取效率的影响。以甲醇为洗脱液,流速2.0mL/min;样品的pH一5.0,流速1.2mL/min,体积1.2mL;检测波长280nm。对蛋清、蜂蜜及葡萄酒中溶菌酶的含量进行了测定,日内与日间精密度分别为2.1%和2.8%;加标回收率>90%。结果表明,建立的镧掺杂二氧化钛/沸石微柱在线预富集一分光光度法具备简单、快速、灵敏度高等优点,适合于蛋清、蜂蜜及葡萄酒中溶菌酶的测定。关键词镧掺杂二氧化钛/沸石;微柱;分光光度法;溶菌酶1引言作为一种吸附材料,沸石在催化、吸附和离子交换领域起着重要的作用]。天然沸石所含杂质成分复杂,表面硅氧结构具有极强的亲水性,且结构外部阳离子易水解,导致其吸附能力达不到要求。可以对沸石进行改性或掺杂处理。已报道的方法有降低硅铝比改性、碱金属改性】、纳米TiO材料改性等。其中,纳米TiO材料具有比表面积大、化学稳定性高、无毒、成本低等优点,得到了广泛关注。如用TiO改性沸石,可以提高沸石对甲基橙等有机物的吸附能力】。研究表明,金属离子掺杂可以增强TiO对目标物的吸附。溶菌酶广泛存在于动物体液、禽类蛋白及植物中,具有抗菌、抗病毒等功效。溶菌酶是蛋清中最主要的蛋白质,约占3.5%;是蜂蜜的特有成分,具有溶细菌的作用;是低度酒的良好防腐剂,可防止产酸菌的生长隅。因此,对溶菌酶的测定十分重要”。由于溶菌酶在实际样品中的含量通常很低,杂质干扰严重,难以直接测定。因此,对样品进行预富集是必不可少的步骤。目前,用于溶菌酶分离的方法有电泳法]、色谱法]、沉淀法和固相萃取法”。其中,固相萃取法操作简便,分析速度快,无环境污染,可与现代分析技术联用。吸附剂的选择是固相萃取的关键,已报道的溶菌酶的吸附剂有壳聚糖衍生物]、交换树脂[18]、牛血清白蛋白一脲醛树脂一ZrO:等。稀土掺杂TiO可以增大TiO:比表面积,对有机物有强吸附作用。本实验制备了La”一TiO/沸石吸附剂,用于溶菌酶的在线分光光度检测,并测定了蛋清、蜂蜜及葡萄酒中的溶菌酶含量。2实验部分2.1仪器与试剂TU1810紫外可见分光光度计(北京普析通用仪器公司);HL-2D恒流泵(上海青浦沪西仪器厂);pH-3SC酸度计(上海雷磁仪器厂);KQ2200DB数控超声清洗器(江苏昆山超声仪器公司);71磁力搅拌器(常州国华公司);DGG-9070AD电热恒温鼓风干燥箱(上海森信实验仪器公司);S-4800场发射扫描电子显微镜(日本Hitachi公司);层析柱(50mm×3mmi.d.,上海北昂科学仪器公司)。溶菌酶(优级纯,Sigma公司);天然沸石采自吉林省九台市,粒径为0.20mm,主要成分及含量(%):sio:(70.96),A1:O,(12.17),CaO(3.52),MgO(1.24),K20(2.93),Na20(0.52)和其它(8.66);La2O3(光谱纯);钛酸丁酯和无水乙醇(优级纯,北京化工厂);甲醇(色谱纯,SKChemicals公司);Nail2PO4、Na2HPO4、NaC1、NaHCO、2010-0%06收稿;201f0811接受本文系中国科学院长春应用化学研究所稀土资源利用国家重点实验室开放基金(2008)项目*Email:jiaqiong@jlu.edu.cn
104分析化学第39卷Na2CO、浓HNO、HC1、三羟甲基氨基甲烷(Tris)、正丙醇均为分析纯。2.2稀土离子掺杂TiO:/沸石复合物的制备2.2.1沸石的预处理称取沸石0.50g,加入50mL1.0%HC1,搅拌3.0~3.5h,过滤,用蒸馏水洗至滤液呈中性后,60℃烘干备用。2.2.2溶胶的制备量取40mL无水乙醇,加入10mL钛酸丁酯和1mLHNO,,搅拌5min,得溶胶A;准确称取0.1436gLa:O,加入2mL浓HC1和48mL水溶解。将溶胶A在搅拌下逐滴(1d/s)加入到上述溶液中,继续搅拌30min,得到掺杂B溶胶,放置12h以上待用。2.2.3La掺杂TiO/沸石复合物的制备将预处理过的沸石置于烧杯中,使其基本覆盖杯底,用少量水润湿,然后烘至无水。量取B溶胶15mL,逐滴加入到上面沸石中至基本覆盖时,烘干,得La什掺杂TiO:/沸石复合物样品。2.3实验流路设置和测量步骤将La计一TiO:/沸石吸附剂填充到层析柱中,用去离子水充分冲洗微柱。在线固相萃取的流路由恒流泵和固相萃取微柱组成,在280nm处测定溶菌酶的浓度。用去离子水冲洗微柱后,引人参比溶液,然后引入溶菌酶样品,使其流经微柱进行富集。富集后用缓冲溶液清洗微柱,最后引入洗脱液(甲醇),将溶菌酶洗脱下来,测定吸光度。3结果与讨论3.1La3掺杂TiO:/沸石复合物的表面形貌特征图1是沸石原样及La”一TiO/沸石复合物的扫描电镜图。由图la可见,沸石原样表面凹凸不平且附着小颗粒,有明显的大小孔洞;La3TiO/沸石复合物(图lb)表面比较光滑平整,未见明显的孔洞,也无颗粒附着,说明La什掺杂的TiO已均匀地负载在沸石表面并进入孔洞中,达到了理想的负载效果。图1沸石(a)及La”TiO/沸石复合物(b)的扫描电镜图Fig.1SEMimagesof(a)zeoliteand(b)zeolitemodifiedwithLa”dopedTiO23.2洗脱液种类的选择分别以二次蒸馏水、NaCI溶液、磷酸盐缓冲液、Tris—HCI一正丙醇、碳酸盐缓冲液及甲醇为洗脱液,比较各种洗脱液对溶菌酶的洗脱效果。结果表明,甲醇洗脱效果最好。3.3萃取条件的优化3.3.1样品溶液pH值的优化用HC1或NaOH调节样品的pH值,在pH1.0~11.0范围内,考察了pH值对萃取效率的影响。由图2a可见,当pH值从1.0增加到5.0时,吸光度值随着pH值的升高而增大;而当pHi5.0时,吸光度值随着pH值的升高而降低。这是因为用掺杂La什的TiO:对沸石进行改性后,其对有机物的吸附能力主要取决于有机物分子大小。随着分子直径的增大,被吸附进入空穴的机会逐渐减少。沸石与分子量小的有机物作用时,吸附起主要作用;沸石与分子量大的有机物作用时,离子交换和吸附共同作用,但以离子交换为主。溶菌酶属于分子量大的有机物,所以两者问的作用以离子交换为主。本实验采用溶胶一凝胶法,以掺杂La抖的TiO:对沸石进行改性,这样可以形成超细的固体吸附剂颗粒,从而提高了吸附能力及阳离子交换能力。溶菌酶的等电点很高(pI一11.0),在接近中性的条件下,溶菌酶带正电荷,所以通过阳离子交换作用很容易吸附溶菌酶。本实验中样品溶液pH一5.0。
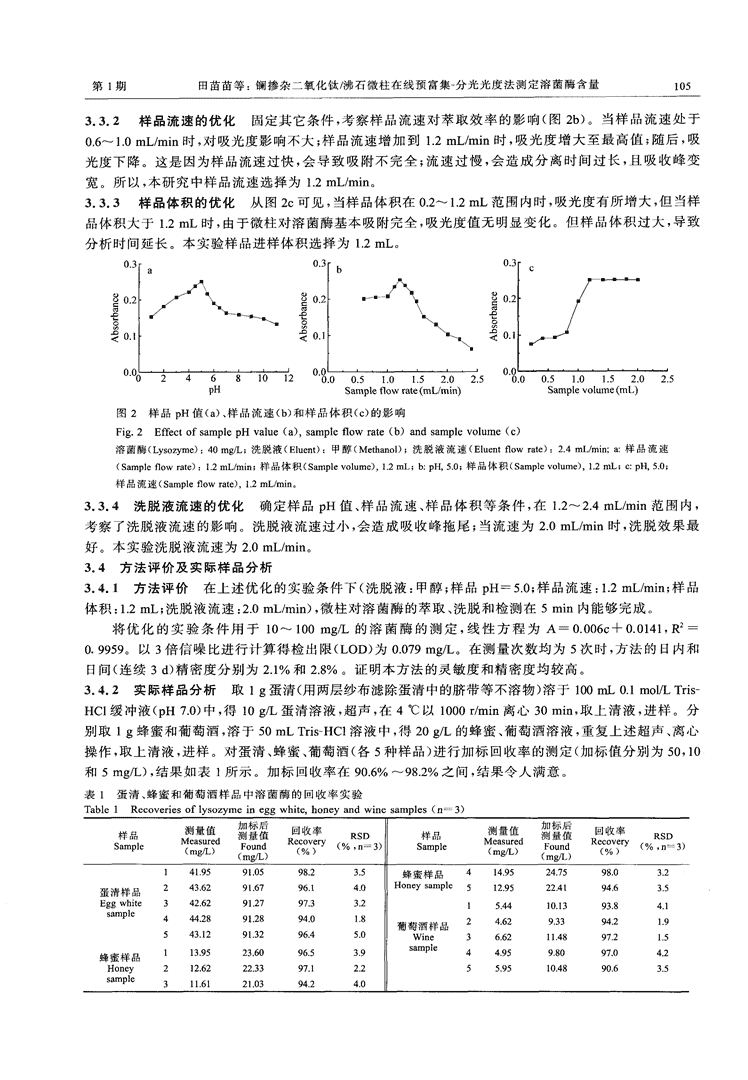
第1期田苗苗等:镧掺杂二氧化钛/沸石微柱在线预富集一分光光度法测定溶菌酶含量1053.3.2样品流速的优化固定其它条件,考察样品流速对萃取效率的影响(图2b)。当样品流速处于0.6-1.0mL/min时,对吸光度影响不大;样品流速增加到1.2mL/min时,吸光度增大至最高值;随后,吸光度下降。这是因为样品流速过快,会导致吸附不完全;流速过慢,会造成分离时间过长,且吸收峰变宽。所以,本研究中样品流速选择为1.2mL/min。3.3.3样品体积的优化从图2c可见,当样品体积在0.2~1.2mL范围内时,吸光度有所增大,但当样品体积大于1.2mL时,由于微柱对溶菌酶基本吸附完全,吸光度值无明显变化。但样品体积过大,导致分析时间延长。本实验样品进样体积选择为1.2mL。图2样品pH值(a)、样品流速(b)和样品体积(c)的影响Fig.2EffectofsamplepHvalue(a).sampleflowrate(b)andsamplevolume(c)溶菌酶(Lysozyme):40mg/L;洗脱液(Eluent):甲醇(Methano1);洗脱液流速(Eluentflowrate):2.4mL/min;a:样品流速(Sampleflowrate):1.2mL/min;样品体积(Samplevolume),1.2mL;b:pH,5.0;样品体积(Samplevolume),l_2mL;c:pH,5.O;样品流速(Sampleflowrate),1.2mL/min。3.3.4洗脱液流速的优化确定样品pH值、样品流速、样品体积等条件,在1.2~2.4rnL/min范围内,考察了洗脱液流速的影响。洗脱液流速过小,会造成吸收峰拖尾;当流速为2.0mL/min时,洗脱效果最好。本实验洗脱液流速为2.0mL/min。3.4方法评价及实际样品分析3.4.1方法评价在上述优化的实验条件下(洗脱液:甲醇;样品pH一5.0;样品流速:1.2mL/min;样品体积:1.2mL;洗脱液流速:2.0mL/min),微柱对溶菌酶的萃取、洗脱和检测在5min内能够完成。将优化的实验条件用于10~100mg/L的溶菌酶的测定,线性方程为A一0.006c+0.0141,R2—0.9959。以3倍信噪比进行计算得检出限(LOD)为0.079mg/L。在测量次数均为5次时,方法的日内和El间(连续3d)精密度分别为2.1%和2.8%。证明本方法的灵敏度和精密度均较高。3.4.2实际样品分析取1g蛋清(用两层纱布滤除蛋清中的脐带等不溶物)溶于100mL0.1mol/LTris—HC1缓冲液(pH7.0)中,得10g/L蛋清溶液,超声,在4℃以1000r/min离心30min,取上清液,进样。分别取1g蜂蜜和葡萄酒,溶于50mLTris~HC1溶液中,得20g/L的蜂蜜、葡萄酒溶液,重复上述超声、离心操作,取上清液,进样。对蛋清、蜂蜜、葡萄酒(各5种样品)进行加标回收率的测定(加标值分别为50,10和5mg/L),结果如表1所示。加标回收率在90.6%~98.2%之间,结果令人满意。表1蛋清、蜂蜜和葡萄酒样品中溶菌酶的回收率实验Table1Recoveriesoflysozymeineggwhite.honeyandwinesamples(n一3)。誉RecoveryRSD。RecoveryRSD141.9591.O598-23.5蜂蜜样品4149524.7598.03.2蛋清样品243,629l·6796-14·0Honeysample512.9522419463.5Eggwhite342·6291-2797.33.215_4410.1393.841,sampJe444.2891.2894.01.8葡萄酒样品24·629.3394.21·9543.1291.3296.45.0Wine36.62l1.4897215蜂蜜样品113-9523-6O96·539sampl。44959.8097.04.2Honey212·6222.3397.12.255.9510.489063.5.sampJe311.6121.039424.0
106分析化学第39卷References1XURu-Ren,PANGWen—Qin,TUKun-Gang(徐如人,庞文琴,屠昆岗).ZeoliteMolecularSieveStructureandSynthesis(沸石分子筛的结构与合成),Changchun(长春):JilinUniversityPress(吉林大学出版社),1987CAOJian-Jin(曹建劲).Ind.Min.Process.(化工矿物与加工),2002,12:1O~11KatohM,KatayamaK,TomidaT.Sep.Sci.Techno1.,1999,34:599——608SUNYe,LIUHong—Ju(孙也,刘宏菊).Petrochem.Techno1.App1.(石化技术与应用),2009,27:1~5XUChun-Fang,HUANGMiao—Iiang,CHENGYing—Han(徐纯芳,黄妙良,程应汉).NewChem.Mater.(化工新型材料),2004,32:29~32CHENGGang,LIUJing,TONGPan—Rui(程刚,刘静,仝攀瑞).J.XianPolytech.Univ.(西安工程大学学报),2008,22:175~178BAIAi-Min,ZOUXin-Ping,YANGShui—Jin(自爱民,邹欣平,杨水金).Chin.J.RareMetals(稀有金属),2005,29:549~5528wuSu—Ping(吴素萍).FoodRes.Develop.(食品研究与开发),2005,26:190~1929ZHANGXin-Bao,CHENHong—Bing(张新宝,陈红兵).FoodSci.Techno1.(食品科技),2008,4:42~451ODUZhuo,ZHANGNa,wANGJian-Hua(杜卓,张娜,王建华).Chem.J.ChineseUniversities(高等学校化学学报),2008,29:902~90511WAGNTing—Xin,LIUZheng—Hao,XIALi—Ya,wUGuang—Chen(王庭欣,刘峥颢,夏立娅,吴广臣).FoodSci.Techno1.(食品科技),2010,35:292~29412KvasnickaF.Ecfr0^0rPss,2003,24:86O~86413RuckensteinE,ZengXF.Biotechno1.Bioeng,,1997,56:61O~61714ZhangCM,LillieR,CotterJ,VaughanD.J.Chromatogr.A,2005,1069:1O7~11215RojasEEG,CoimbraJSD,MinimLA,SaraivaSH,SilvaCAS.J.Chromatogr.B,2006,840:85~9316ZhouQX,DingYJ,XiaoJP.Ana1.Bioana1.Chem.,2006,385:1520~152517FENGChang—Gen,BAILin—Shan,RENQi—Sheng(冯长根,白林山,任启生).IonExch.Adsorp.(离子交换与吸附),2003,19:282~28818LIXiu—Jin,ZHONGFeng(李秀锦,仲峰).J.Chin.Inst.FoodSci.Techno1.(中国食品学报),2003,3:17~2119LULing-Ling,LINai—Xuan(鲁玲玲,李乃碹).J.TianjinUniv.Techno1.(天津理工大学学报),2007,23:81~84SpectrophotometricDeterminationofLysozymebyOn—linePrecOncentrati0nwithAMicrocolumnContainingLa3+-TiO2一ZeoliteTIANMiao—Miao,SURi—Yan,JIAQiong,BAOChang-Ii,QUANXinJun(CollegeofChemistry,JilinUniversity,Changchun130022)AbstractAspectrophotometricmethodforthedeterminationoflysozymewasestablishedbasedontheon—linepreconcentrationwithaLa计一TiO2一zeolitemicrocolumn.Effectsofoperationparametersontheextractionefficiencywereoptimizedasfollows:methanolastheeluentwithaflowrateof2.0mL/min。samplepHof5.0,sampleflowrateof1.2mI/min,samplevolumeof1.2mL,anddetectionwavelengthof280nm.Theproposedmethodwasemployedforthedeterminationoflyso—zymeineggwhite,honey,andwinesamples.Therelativestandarddeviationsofintra—dayandinter—dayweredeterminedas2.1%and2.8,respectively.Therecoverieswerehigherthan90.Themethodissimple,rapid,sensitive.KeywordsLanthanum㈣一titamiumoxide—zeolite;Microcolumn;Spectrophotometry;Lysozyme(Received6July2010;accepted11August2010)'
您可能关注的文档
- 碳四烯烃中微量羰基化合物含量的测定分光光度法,SH_T1493-2015.pdf
- 乙烯-丙烯共聚物(EPM)和乙烯-丙烯-二烯烃三元共聚物(EPDM)中钒的测定分光光度法,SH_T1814-2017.pdf
- 橡胶结合苯乙烯含量的测定 分光光度法,GB_T13646-2013.pdf
- 酚试剂分光光度法在室内甲醛检测中的实际应用.pdf
- 紫外-可见分光光度法习题与答案.doc
- 基于脉动变光程的分光光度法自标定检测磷酸盐.pdf
- 基于碳量子点荧光分光光度法检测叶酸.pdf
- 碱溶分光光度法测定植硅体碳含量.pdf
- 磺基水杨酸分光光度法测铁.doc
- 分光光度法测定地下水中六价铬的不确定度评定.pdf
- 现代化学化工分析方法与实验技术教学教案紫外-可见分光光度法.ppt
- 原子吸收法与分光光度法测煤灰中铁含量比对研究.pdf
- 硅钼黄分光光度法测定地下水中偏硅酸的不确定度评定.pdf
- 硅钼蓝分光光度法测定铬铁矿石中的二氧化硅.pdf
- 系数倍率双波长分光光度法同时测定钢样中的铝和铜的含量.pdf
- 紫外可见分光光度法测定地表水和地下水的高锰酸盐指数.pdf
- 紫外分光光度法测定湿法炼锌净化液中的亚硝酸根.pdf
- 《仪器分析解析实验》实验2-3紫外-可见分光光度法.ppt