- 990.00 KB
- 104页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience第6章吸光光度法学习要求:1.掌握吸光光度法的有关概念;2.掌握光的吸收定律及其适用范围;3.掌握分光光度法的分析方法;4.了解显色反应及其条件的选择;5.了解分光光度法仪器测量的误差及测量条件的选择;6.了解分光光度法的特点及某些应用。
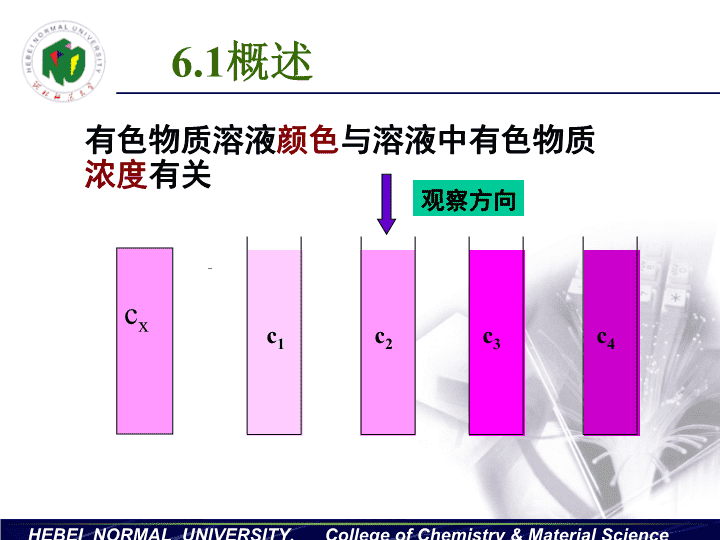
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience6.1概述c1c2c3c4cx有色物质溶液颜色与溶液中有色物质浓度有关观察方向
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience吸光光度法:物质对光的选择性吸收而建立起来的分析方法。
分光光度法HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience仪器:分光光度计测定:吸收光谱曲线定性、定量分析
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience20.1.1光度分析法的特点(1)灵敏度高测微量、痕量组分分析,下限可达10-4%~10-5%或10-3~10-6mol·L–1。(2)较高的准确度比色法的相对误差为5%~10%,分光光度法为2%~5%,可满足微量分析的要求。若使用精密度高的仪器,误差可达1%~2%。(3)操作简便、仪器简单。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience20.1.2物质对光的选择性吸收光是一种电磁波,按波长排列,可得电磁波谱表。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience表6-1电磁波谱范围表P214光谱名称波长范围跃迁类型分析方法X射线10-1~10nmK和L层电子X射线光谱法远紫外光10~200nm中层电子真空紫外光度法近紫外光200~400nm价电子紫外光度法可见光400~750nm价电子比色及可见光度法近红外光0.75~2.5μm分子振动近红外光谱法中红外光2.5~5.0μm分子振动中红外光谱法远红外光5.0~100μm分子转动和低位振动远红外光谱法微波0.1~100cm分子转动微波光谱法无线电波1~1000m分子转动核磁共振光谱法
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience近紫外:200-400nm可见光:人眼能感觉到的波长400-750nm的光。白光:由红、橙、黄、绿、青、蓝、紫光按一定比例混合而成的复合光。
比色分析及可见光区吸光光度法:物质分子或离子对可见区域光的吸收。波段:400-750nmHEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience单色光:同一波长的光。λ=500nm,绿光复合光:由不同波长的光组合而成的光。互补色光:两种光按一定比例混合可得到白光,这两种单色光称为互补色光。见表20-2。
/nm颜色互补光400-450紫黄绿450-480蓝黄480-490绿蓝橙490-500蓝绿红500-560绿红紫560-580黄绿紫580-600黄蓝600-650橙绿蓝650-750红蓝绿不同颜色的可见光波长及其互补光HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience物质对光的选择性吸收颜色与光的关系:白光全吸收白光全透过吸收黄光
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience看到的是固体物质反射或溶液透射的光。物质(溶液)吸收的光是反射或透射光的互补光。溶液颜色的深浅,取决于溶液中吸光物质浓度的高低。物质的颜色:物质对光的选择性吸收
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience为什么物质对光呈现选择吸收?单一吸光物质的分子或离子只有有限数量电子能级的缘故。
同一种物质对不同波长的光表现出不同的吸收能力。如:溶液呈现颜色不同的物质对光的选择吸收性质不同。KMnO4紫红色K2Cr2O7橙色物质对光的选择吸收:HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience光选择吸收的性质:反映了分子内部结构的差异,各物质分子能级千差万别,内部各能级间的间隔也不相同。有色溶液:目视比色法分析吸光光度法
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience无色溶液对光有吸收?醋酸水溶液:吸收一定波长的紫外光,吸光光度法测定。
吸收光谱曲线将各种波长的单色光依次通过一定浓度的(有色)溶液,并测定每一波长下有色溶液对光的吸收程度(A)。以波长(λ)为横坐标,A为纵坐标作图,得到的曲线,称吸收光谱曲线。最大吸收波长λmax:光吸收程度最大处对应的波长。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience不同浓度KMnO4的吸收光谱曲线浓度不同,A不同,λmax不变。A、λmax是定性、定量分析参数
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience20.2光吸收基本定律20.2.1朗伯-比尔定律I0IrItIaI0=Ir+It+IaI0=It+IaT-透光率(透射比)A-吸光度
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScienceA=lg(I0/It)=lg(1/T)=-lgT朗伯定律(1760年):光吸收与溶液液层厚度成正比比尔定律(1852年):光吸收与溶液浓度成正比
当一束平行单色光垂直照射到样品溶液时,溶液的吸光度与溶液中吸光物质的浓度及溶液的厚度成正比—朗伯比尔定律光吸收基本定律:定量依据数学表达:A=lg(1/T)=KbcK:比例常数,b:溶液厚度,c:溶液浓度朗伯-比尔定律
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience14K:与吸光物质的性质、入射光波长及温度有关,称为吸光系数或吸收系数。与吸光物质的浓度、吸收池的厚度、材料无关。K取值与单位取决于c、b的单位:
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience当c:mol/L,b:cm,用ε表示,摩尔吸收系数L·mol-1·cm-1A=lg(1/T)=κbc当c:g/L,b:cm,用a表示,吸收系数L·g-1·cm-1A=lg(1/T)=abc
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience光度法灵敏度ε的物理意义:κ是各种吸光物质在特定波长下的一个特征常数。数值上等于1cm的溶液厚度中吸光物质浓度为1mol·L-1时的吸光度。吸光能力量度。ε可表示显色反应的灵敏度。
ε是有色化合物的重要特性。定性参数。ε愈大,表示该物质对某波长的光吸收能力愈强,光度测定的灵敏度就越高。反映灵敏度。ε值不能直接取1mol/L这样高浓度的有色溶液来测量,而只能通过实验数据计算求得。
溶液中吸光物质的浓度常因离解、聚合等因素而改变。计算ε时,必须知道溶液中吸光物质的真正浓度。通常在实际工作中,多以被测物质的总浓度计算,这样计算出的ε值称为表观摩尔吸光系数。文献中所报道的ε值就是表观摩尔吸光系数值。
P398例题A=lg(1/T)=εbcA=0.390b=2c=1.0mg/L=1.0×10-3/55.85=1.8×10-5mol/Lε=A/bc=0.390/2×1.8×10-5=1.1×104L·mol-1·cm-1
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience桑德尔灵敏度SS:仪器的检测极限为A=0.001时,单位截面积光程内所能检测出来的吸光物质的最低含量,单位为μg·cm-2。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScienceA=0.001,A=0.001=εbc,mol/L×cm→(mol/1000cm3)×cm故bc为单位截面积光程内的物质量。S与ε的关系
例已知双硫腙光度法测Cd2+时ε520=8.8×104,求桑德尔灵敏度MCd=112.4S越小,灵敏度越高。
S=MCd/κ520=112.4/8.8×104=1.3×10-3μg/cm2
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience20.2.2吸光度的加和性溶液中多种组分,都对某λ光有吸收各吸光组分彼此不作用:A=A1+A2+……+An吸光度的加和性。该规律可用于多组分的测定。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience20.2.3对朗伯-比尔定律的偏离A=kbcA对c作图,应为一通过原点的直线,称为工作曲线(或称标准曲线)。有时会在工作曲线的高浓度端发生偏离。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience偏离比耳定律的原因主要有:1.比耳定律的局限性假设了吸光粒子之间无相互作用,因此仅在稀溶液的情况下适用。溶液浓度较高(c>0.01mol·L-1)时,吸光粒子之间平均距离缩小,可能存在相互作用,其对光吸收的能力会改变。因此,高浓度时,A与c的线性关系发生偏离。一般适用于小于0.01mol/L稀溶液。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience2.非单色入射光引起的偏离朗伯-比耳定律仅适用于单色光。一般仪器单色器所获得的光是有一定波长范围的复合光,这些非单色光会引起对比尔定律的偏离。这并不是定律不正确,而是由于仪器条件的限制所造成的。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience设入射光由λ1和λ2组成,入射光强度为I01和I02,对应透过光强为I1和I2。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScienceκ1=κ2A~c线性关系κ1≠κ2A~c偏离线性关系κ1、κ2相差越大,偏离越严重
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience选择较纯单色光(Δλ↓,单色性↑)选λmax作为测定波长(Δκ↓,S↑且成线性)
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience3.由介质的不均匀引起的偏离朗伯-比耳定律适用于均匀、非散射溶液。当被测溶液是胶体溶液、悬浊液或乳浊液时,入射光通过溶液后除一部分被吸收外,还有一部分因溶液中存在微粒的散射作用而损失,并使透光度减小。向吸光度轴弯曲-正偏离。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience而当胶体或其他微粒凝聚沉淀时,又会使溶液吸光度下降。向浓度轴弯曲-负偏离。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience4.样品溶液因素溶液组分间的相互作用不可避免Cr2O72-离子在水溶液中存在着二聚平衡Cr2O72-+H2O2HCrO42-2H++2CrO42-450nm橙375nm黄控制溶液酸度为酸性
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience例.一符合朗伯比尔定律的有色溶液,当浓度为c时,透射比为T,若其它条件不变,浓度为c/3时,T为__,浓度为2c时,T为__。
解:-lgT=kc-lgT1=kc/3T1=T1/3T2=T2这说明浓度与透射比T的是指数关系。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience比色法和分光光度法及其仪器目视比色法c1c2c3c4cx=c2或cx=(c1+c2)/2。方便、灵敏,准确度差,常带有主观误差。cx观察方向
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience分光光度计光源单色器吸收池检测器显示装置I0IrItIa
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience光源:发出所需波长范围内的连续光谱,有足够的光强度,稳定。可见光区:钨灯,碘钨灯(320~2500nm)
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience单色器:将光源发出的连续光谱分解为单色光的装置称为色散原件,由入射狭缝、出射狭缝和准直镜组成单色器。棱镜:玻璃350~3200nm,石英185~4000nm光栅:波长范围宽,色散均匀,分辨性能好,使用方便。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience棱镜:依据不同波长光通过棱镜时折射率不同单色器入射狭缝准直透镜棱镜聚焦透镜出射狭缝白光红紫λ1λ2800600500400
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience光栅:在镀铝的玻璃表面刻有数量很大的等宽度等间距条痕(600、1200、2400条/mm)。原理:利用光通过光栅时发生衍射和干涉现象而分光。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience吸收池:(比色皿)用于盛待测及参比溶液。可见光区:光学玻璃池紫外区:石英池注意:透光面垂直于光束方向,并保持比色皿的光洁。
检测器:利用光电效应,将光能转换成电流讯号。光电池,光电管,光电倍增管
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience检测器Seh硒光电池Ag、Au结构简单,价廉,易疲劳。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience光电管红敏管625-1000nm蓝敏管200-625nm灵敏度高,光敏范围广,不易疲劳。90VDC直流放大阴极R-+光束e阳极丝(Ni)抽真空
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience读数指示器:将光电流或放大信号显示或记录下来。低档仪器:刻度显示中高档仪器:数字显示,计算机自动扫描记录
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience上刻度:A下刻度:T两者关系T=65%A=lg100-lg65=0.187
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience读数时,应读A,因A与C成正比。T~C指数关系
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience20.4显色反应与显色条件的选择能使被测物质生成有色化合物的反应,叫显色反应,所用的试剂为显色剂。使用显色反应的必要性:待测物质本身无色或颜色很浅显色反应的类型:氧化还原反应、配位反应。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScienceM+nR=MRn被测离子显色剂有色配合物1.灵敏度高,有色物质的ε值一般应为104~105L·mol–1·cm–1;2.选择性好,只与被测组分显色,干扰少;3.有色配合物组成一定,性质稳定;20.4.1对显色反应的要求
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience4.有色化合物与显色剂之间的颜色差别要大。通常用“反衬度”或“对比度”表示,对比度一般应大于60nm。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience20.4.2显色反应条件的选择实际中,为提高准确度,了解影响显色反应的因素,控制其最佳分析条件。条件通过实验得到。条件:溶液酸度、显色剂用量、试剂加入顺序、显色时间、显色温度等。
1.显色剂用量一般需过量。但有时并非显色剂过量越多越好。实际用量由条件实验决定。方法:固定金属离子的浓度,在其他条件不变的情况下,改变显色剂用量,分别测定吸光度。以吸光度对显色剂用量做图。由图中曲线选择适宜的用量。显色反应:M+R=MR
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialSciencec(R)c(R)c(R)Mo(SCN)32+浅红Mo(SCN)5橙红Mo(SCN)6-浅红Fe(SCN)n3-n1.显色剂用量
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience2.溶液的酸度①影响显色剂的平衡浓度和颜色:显色剂大多为有机弱酸,酸度会影响其平衡浓度;M+nR=MRn+nH+=nHR当c(H+)增大,c(R)减小,使配位反应不完全。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience②影响配合物的组成例如,Fe3+与磺基水杨酸的显色反应,在不同酸度下,可生成1:1、1:2、1:3三种颜色不同的配合物。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialSciencepH1.8~2.54~88~11.5>12组成1:11:21:3Fe(OH)3颜色紫色棕色黄色Fe3+与磺基水杨酸配合物
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience③影响被测离子的存在状态许多金属离子在酸度降低时会水解形成羟基配合物、碱式盐、或氢氧化物沉淀。
HEBEINORMALUNIVERSITY,CollegeofChemistry&MaterialScience酸度的选择:固定被测组分与显色剂的浓度,调节溶液不同的酸度,测定吸光度,绘制pH值与A的曲线,从中找到适宜的酸度。pH1
您可能关注的文档
- 火焰原子吸收分光光度法测总铬实验步骤
- 甲醛的检验方法AHMT分光光度法
- 紫外分光光度法应用举例
- 邻氮二菲分光光度法测定微量铁
- 紫外——可见分光光度法教学
- 紫外可见分光光度法实验
- GBT 16128-1995 居住区大气中二氧化硫卫生检验标准方法 甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法.pdf
- 双等色点分光光度法测定络合物稳定常数
- 《分光光度法简介》PPT课件
- 《可见分光光度法》PPT课件
- 仪器分析紫外-可见分光光度法单元测验题及参考答案
- 郭小洁-紫外-可见分光光度法在药品检验中的应用
- 磷含量的测定(钼酸铵分光光度法)
- 紫外分光光度法测氧氟沙星片剂中氧氟沙星的含量
- 邻二氮杂菲分光光度法测定铁_实验报告(精)
- 紫外分光光度法在药物分析中的应用
- 4-氨基安替比林萃取分光光度法测定水中挥发酚的质量控制指标研究
- 火焰原子吸收分光光度法测定爆米花中铅含量