- 1.07 MB
- 76页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'第三章紫外可见分光光度法UltravioletandVisible(UV-Vis)Spectrophotometry
1.产生及特征;2.光吸收基本定律;3.仪器部件及其类型;4.定性分析和定量分析方法及其应用。
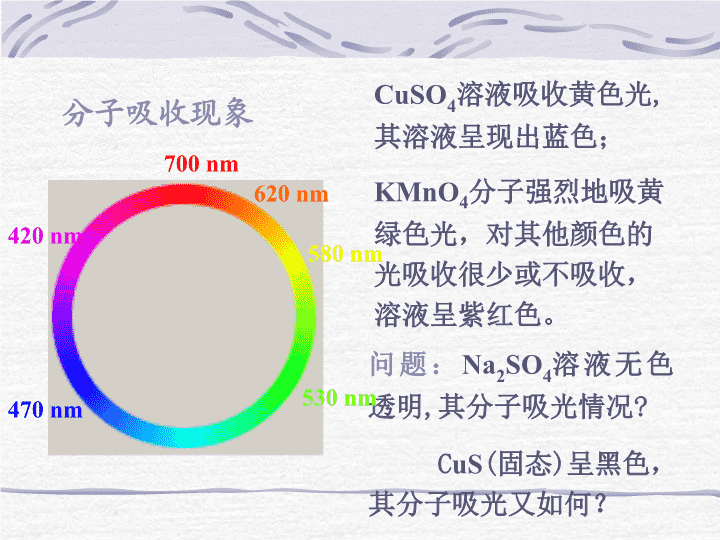
分子吸收现象CuSO4溶液吸收黄色光,其溶液呈现出蓝色;KMnO4分子强烈地吸黄绿色光,对其他颜色的光吸收很少或不吸收,溶液呈紫红色。问题:Na2SO4溶液无色透明,其分子吸光情况?CuS(固态)呈黑色,其分子吸光又如何?700nm530nm420nm580nm470nm620nm
3.1分子吸收光谱一、分子吸收光谱的产生当照射在物质分子上的光的能量与分子的电子能级跃迁所需能量一致时,就会产生分子吸收。
(一)分子能级与电磁波谱分子中包含有原子和电子,分子、原子、电子都是运动着的物质,都具有能量,且都是量子化的。
物质分子内部运动状态有三种形式:①电子运动:电子绕原子核作相对运动;
②原子运动:分子中原子或原子团在其平衡位置上作相对振动;
③分子转动:整个分子绕其重心作旋转运动。
核外电子的类型成键电子:电子电子非键电子:n电子
分子的三种能级跃迁示意图
二、电子跃迁的类型
1.-*跃迁能量差大所需能量高吸收峰在远紫外(<150nm)甲烷:125nm;乙烷:135nm2.-*跃迁能量差较小所需能量较低吸收峰紫外区(200nm左右)3.n-*跃迁能量较低收峰紫外区(200nm左右)(与-*接近)三甲基胺(CH3)3N-的n-*吸收峰在227nm
4.n-*跃迁能量低吸收峰在近紫外、可见区(200~700nm)含有杂原子的不饱和基团,如-C=O,-CN等各种跃迁所需能量大小次序为:-*>n-*-*>n-*
基本概念1、生色团具有轨道的不饱和官能团称为发色团。有“共轭大键”(离域键)时,与*间的能量差减小,生色作用大大增强。2、助色团本身不“生色”,但能使生色团生色效应增强的官能团。含有孤对电子的基团:—NH2—OH—SH
3、红移和紫移红移:吸收峰向长λ移动的现象;紫移:吸收峰向短λ移动的现象;增强效应:吸收强度增强的现象;减弱效应:吸收强度减弱的现象。
三.吸收光谱吸收光谱(吸收曲线):吸光度(A)~波长()吸收峰:曲线上比左右相邻处都高的一处;max:吸收程度最大所对应的谷:曲线上比左右相邻处都低的一处;min:最低谷所对应的;肩峰:介于峰与谷之间,形状像肩的弱吸收峰;
吸收曲线示意图
四、无机化合物的吸收光谱1、金属离子:d电子跃迁稀土离子:f电子跃迁2、配合物电荷转移Fe3+—SCN-Fe2+—SCNhv
3.2Lambert-Beer定律一、透射比和吸光度I0=Ia+It+IrI0——入射光强度Ia——吸收光强度It——透过光强度Ir——反射光强度
若吸收池的质量和厚度都相同,则Ir基本不变,在具体测定操作时Ir的影响可互相抵消(与吸光物质的c及b无关):I0=Ia+It采用空白溶液作为参比:测量前在比色皿中装上空白溶液,测量此时的透过光强度It。
对光吸收程度表示:透光率:T=It/I0吸光度:A=lg(1/T)=lg(I0/It)T=10%时,A=1.0空白测定:设定空白溶液的吸光度为0,即透过率T=100%。
二、Lambert-Beer定律——光吸收基本定律“Lambert-Beer定律”是说明物质对单色光吸收的强弱与吸光物质的浓度(c)和液层厚度(b)间的关系的定律,是光吸收的基本定律,是紫外-可见光度法定量的基础。
Lambert-Beer定律推导:P26
A=lc吸收介质之间没有相互作用吸光度具有加合性
Lambert定律:A=k"lBeer定律:A=k"cLambert-Beer定律:A=klc当c用g/L、b用cm为单位时,k用吸光系数a表示,单位为L/g·cm当c用mol/L、b用cm为单位时,k用摩尔吸光系数表示,单位为L/mol·cm
光吸收定律的有关名称和符号
吸光度的加和性设某一波长()的辐射通过几个相同厚度的不同溶液c1,c2···cn,其透射光强度分别为I1,I2···In,根据吸光度定义:这一吸光体系的总吸光度为:A=lgI0/InA1+A2+···+An=lgI0/I1+lgI1/I2+···+lgIn-1/In=lgI0/InA=lgI0/In=A1+A2+···+An
三、引起偏离Lambert-Beer定律的因素1.吸收定律本身的局限性稀溶液中才能成立(吸收介质之间没有相互作用)2.化学因素Cr2O42-+H2O2CrO42-+2H+3.仪器因素(非单色光的影响)4.其它光学因素:散射和反射、非平行光
3.3紫外-可见分光光度计一、主要部件光源单色器信号输出检测器样品池
1.光源:提供入射光的装置;(1)钨灯或碘钨灯>350nm,可见光(2)氢灯或氘灯:150~400nm,紫外光(3)氙灯200~700nmUVregionVisibleregion
2.单色器:色散元件:光栅狭缝准光镜聚焦元件光源色散元件入射狭缝
3.吸收池:光学玻璃吸收池——只能用于可见区石英吸收池——可用于紫外及可见区
4.检测器:硒光电池光电管光电倍增管二极管阵列photochathodeanodehighvoltagevoltagedividernetworkdynodeslightelectrons
LightLensEntranceSlitRotatingGratingExitSlitDetectorMeasureonewavelengthbandatatime.Serialdetectionscheme.ArrayDetectorMeasurealargerangeofwavelengthssimultaneously.Paralleldetectionscheme.
5.显示器:电表指针数字显示荧光屏显示电脑
二.分光光度计的类型1.单波长、单光束分光光度计(721、722、752型等)一个单色器;一种波长的单色光;一束单色光。2.单波长双光束分光光度计从一个单色器获取一个波长的单色光用切光器分成二束强度相等的单色光,消除了光源不稳定性。
3.双波长分光光度计二个单色器得到二个波长不同的单色光。两束波长不同的单色光(1、2)交替地通过同一试样溶液(同一吸收池)后照射到同一光电倍增管上,最后得到的是溶液对1和2两束光的吸光度差值∆A。
SinglebeamDoublebeamDoubleλ,doublebeamSourceλselectorSampleTransducerOutputSourceλselectorSampleTransducerOutputBlankSourceλ2selectorTransducerOutputλ1selectorSample
3.4分析条件的选择一.影响显色反应的因素及反应条件的选择(一)显色反应的选择1.选择性好:干扰少或易排除;2.灵敏度高(S):尤其是对低含量组分,一般选择:104~105L/mol·cm3.有色化合物稳定、组成恒定4.有色化合物与显色剂的颜色差别大
(二)影响显色反应的因素及反应条件显色剂的用量溶液的酸度显色时间:显色温度溶剂:
二.分光光度法测量误差及实验条件的选择(一)测量误差及A范围的选择当T%=36.8%即A=0.434时,∆c/c最小;当T%在15-65%之间即A在0.2~0.8范围内,∆c/c较小。(二)测量波长选择一般根据吸收光谱选择max测定——灵敏度高、A随波长变化小
三、参比溶液的选择溶剂参比:当溶液中只有待测组分在测定波长下有吸收,而其它组分无吸收时—用纯溶剂作参比;试剂参比:如果显色剂或其它试剂有吸收,而待测试样溶液无吸—用不加待测组分的其它试剂作参比;试样参比:如果试样基体有吸收,而显色剂或其它试剂无吸收—用不加显色剂的试样溶液作参比;平行操作参比:
四、干扰及消除方法控制溶液的酸度选择适当掩蔽剂利用生成惰性配合物选择适当的波长分离
3.4紫外-可见分光光度法应用一.定性分析(辅助方法)在相同的条件下测定相近浓度的待测试样和标准品的溶液的吸收光谱,然后比较二者吸收光谱特征:吸收峰数目及位置、吸收谷及肩峰所在的位置等;分子结构相同的化合物应有完全相同的吸收光谱。
1、Woodward-Fieser规则计算共轭二烯、多烯烃及共轭烯酮类化合物跃迁最大吸收波长的经验规则。共轭二烯、多烯烃:p39共轭烯酮类化合物:p402、Scott规则类似于Woodward-Fieser规则,用于计算芳香族羰基衍生物的跃迁最大吸收波长的经验规则。
共轭二烯、多烯烃类化合物跃迁最大吸收波长计算基值217nm基值253nm
增加一个共轭双键30环外双键5每个烷基取代5-O-乙酰基0-O-R6-S-R30-Cl,-Br5-NR260溶剂校正值0
基值253nm环外双键5nm烷基取代(3×5)15nm273nm
基值253nm环外双键5nm烷基取代(4×5)20nm共轭系统延长30nm308nm
基值253nm烷基取代(5×5)25nm-O-乙酰基取代0nm共轭系统延长(2×30)60nm环外双键(3×5)15nm353nm
2.14有两种异构体,α异构体的吸收峰在228nm(ε=14000),而β异构体的吸收峰在296nm(ε=11000)。试指出这两种异构体分别属于下面两种结构中的哪一种。(1)(2)
二、结构分析1、判别顺反异构番茄红素、偶氮苯反式异构体的lmax和emax大2、判别互变异构烯醇式——酮式烯醇式的lmax和emax大
三、定量分析半定量:比色法
定量分析方法的依据是Lambert-Beer定律(一)单组分定量1.标准曲线法:配制一系列(5~10)个不同c的标准溶液,在适当(通常为max)下,以适当的空白溶液作参比,分别测定A,然后作A-c曲线同条件下测定试样溶液吸光度Ax,查找对应的cx。2.直接比较法:已知试样溶液基本组成,配制相同基体、相近浓度的标准溶液,分别测定吸光度A标、A样
例用紫外吸收光谱方法测定某药物,采用1cm比色皿在280nm处测定标准溶液及未知样品所得吸光度值如下:(1)求该药物在此波长下得摩尔吸光系数,该方法的灵敏度,未知样品中药物的浓度。(2)如果对空白样品测定20次所得标准偏差为0.003,则该方法的检出限为多少?C/10-4mol/L0.01.02.03.04.05.0未知A0.000.2030.4050.5980.8120.9880.720
解:以A对C作图
得线性方程:A=0.00386+0.19886Ce=A/bc=0.19886/1*104=1.99*103方法的灵敏度为标准曲线的斜率0.19886/(104L/mol)=1.99*103L/mol未知样品中药物的浓度C=(0.720-0.00386)/0.19886=3.6*10-4mol/L检出限DL=3*0.003/(1.99*103L/mol)=4.5*10-6mol/L
(二)多组分定量吸光度具有加合性的特点。混合组分的吸收光谱相互重叠的情况不同,测定方法也不相同,常见混合组分吸收光谱相干扰情况有以下三种:
1.第一种情况:各种吸光物质吸收曲线不相互重叠或很少重叠,则可分别在1及2处测定a及b组分的c;2.第二种情况:部分重叠,先在1处测得ca,再在2处测得混合组分的吸光度Aa+b,根据吸收定律加和性:Aa+b(2)=Aa(2)+Ab(2)=a(2)·b·ca+b(2)·b·cb应先求得a(2)与b(2),并使用相同b,即可求得cb。3.第三种情况:两吸收曲线互相重叠
(1)解方程组法:若试样中需要测定两种组分,则选定两个波长1及2,测得试液的吸光度为A1和A2,则可解方程组求得组分a、b的浓度ca、cb:A1=a(1)·b·ca+b(1)·b·cbA2=a(2)·b·ca+b(2)·b·cb对含有n个组分的混合物,在n个适当波长处进行n次测量,然后解n个联立方程以求得各组分的浓度。
(2)等吸光度双波长(消去)法吸收光谱重叠的a(虚线)、b(实线)两组分共存,现设法把一种组分(b)的吸光度消去。A1=A1a+A1b+A1sA2=A2a+A2b+A2sA=A2a-A1a+A2b-A1b=A2a-A1a=(2a-1a)·b·ca
(三)、示差分光光度法用于待测组分含量高的样品。采用比试样浓度稍低的样品做参比,结果相当于标尺放大。Ax=·b·cxAs=·b·csA=·b·(cx-cs)=·b·c待测试液的透射比为5%(A=1.3),若用透射比为10%(A=1.0),此时透射比则为50%(A=0.3)
四、配合物的组成及稳定常数的测定1、摩尔比法(饱和法)根据金属离子M在与配体R反应过程中被饱和的原则来测定配合物组成。M+nR=MRn适合于离解度小、组成比高的配合物组成的测定。
[MRn]=(1-α)c[M]=αc[R]=αncα=(A’-A)/A’
2、等摩尔连续变化法(Job法)配制一系列总浓度恒定的溶液,在配合物最大吸收波长下测定溶液吸光度。
五、酸碱离解常数的测定一元弱酸在溶液中的离解反应为:HL=H++L-离解常数:Ka=[H+][L-]/[HL]pKa=pH+lg[HL]/[L-]配制出三份不同pH的HL溶液,一份为强碱性溶液,另一份为强酸性溶液,分别在L-和HL的吸收峰波长处测定吸光度,由此计算出L-和HL的摩尔吸光系数。第三份为已知pH值的缓冲液,其pH值在pKa附近,在测得L-和HL的总吸光度后用双组分测定的方法算出L-和HL的浓度,即可计算出弱酸的离解常数。
例:准确称取弱酸HB试样1.00g8份,分别用不同pH值的缓冲溶液溶解,全部溶液在某一波长、同一操作条件下测定其吸光度。已知弱酸HB的阴离子B-在该测定波长下为唯一的吸光成份,试根据下列数据计算该弱酸HB的Ka.pH4567891011A0.000.000.060.390.951.131.181.18解:由上述数据可知,pH≤5时,弱酸全部以HB形式存在,A=0.0;pH≥10时,弱酸全部以B-形式存在,A=1.18。所有溶液HB的分析浓度均相同为c0,则有1.18=ebc0→→c0=1.18/eb①在任何pH条件下,〔B-〕Ka[H+]+Ka又A=eb[B-]=1.18Ka/([H+]+Ka)②已知pH=8时、A=0.95代入②,求得Ka=4.1×10-8pH=9时、A=1.13、Ka=2.3×10-8pH6789A0.060.390.951.13Ka×1085.34.94.12.3Ka的平均值:为所求。
如何提高分光光度法的检测极限?A=ebc或c=A/eb,欲使待测组分浓度c尽可能小,决定于以下因素①可准确测量的吸光度A值愈小:这始终是仪器制造商追求的目标,目前,高精度分光光度计可准确测量到0.0001吸收单位。②增大吸收池光程:用1~4m全反射长光路毛细吸收管用于天然水中超痕量磷,可测至0.1ppt级。③增大有色化合物的e:目前,有不少二元或三元配合物的显色反应生成的有色络合物的e为105级,少数达106级。可以估算出常规分光光度法的极限测定浓度:假定可准确测量的A=0.0001,采用5cm的比色皿,e为5.0×106,则c=4×10-10molL-1分光光度法已成为痕量分析的重要工具
§3.5具体应用示例无机阴、阳离子的测定利用高灵敏、高选择性的有机显色剂,与被测无机离子发生配合或氧化还原反应,可测定周期表中绝大多数元素
两组分的同时测定例:临床中麻醉剂:普鲁卡因丁卡因注射液它含有两种成分:盐酸普鲁卡因和盐酸丁卡因这两种化合物结构相似,最大吸收波长分别为291和312nm。但盐酸丁卡因的毒性比前者大10倍,因此配制时应严格限制其含量双波长法的应用可采用双波长,利用吸光度具有加和性来测定和求解,以减少二种化合物吸收峰重叠而产生的测量误差参见,药学通报,18(15),7(1983)
消除浑浊背景干扰例:血清中胆红素的测定胆红素的测定对治疗或预防脑核性黄疸有决定性意义,但高含量的胆红素容易导致样品浑浊,且血清中的血红蛋白在胆红素最大吸收(460nm)处有吸收也干扰测定,采用波长组合为461、551nm测定胆红素,可有效地消除浑浊和血红蛋白的吸收干扰已制成专用的双波长分析仪器,称为胆红素仪,在临床实验室中广泛使用
有机化合物的定量分析直接法若有机化合物本身在结构上含有双键或芳环,即含有共轭电子,则可直接测定其含量
间接法被测组分不吸光或ε很小共存组分对测定有严重干扰(1)氧化反应常用于药物分析中在5molL-1H2SO4介质中,用0.1mlL-1K2Cr2O7氧化联苯羟胺为二苯酮,其lmax为257nm
(2)缩合反应①如微量氨基酸的测定氨基酸的吸收波长在280nm左右,且ε较小,低含量的氨基酸很难用直接法准确测定。可用茚三酮与各种氨基酸反应,生成无色还原型茚三酮,过量的茚三酮又与还原型茚三酮和氨缩合生成紫蓝色产物,称为Ruhemann紫,lmax=570nm,利用此反应可测微量的氨基酸这个反应还广泛应用于蛋白质序列结构分析中
②食品中糖的测定各种糖与蒽酮在H2SO4介质中反应,生成的蓝绿色化合物(特效反应)。若改变反应时间、温度,可测出果蔬中葡萄糖、果糖、蔗糖的含量蓝绿色640nm
与金属离子生成有色配合物安眠镇静药物苯并噻嗪类化合物,在pH=2时与Pb2+反应生成红色配合物
本章小结吸收光谱的产生Lambert-Beer定律紫外-可见分光光度计定性分析和定量分析方法及其应用
课后作业P50-52:3.113.163.183.193.25'
您可能关注的文档
- 可见分光光度法测定铁的含量.ppt
- 萃取分光光度法.ppt
- 第10章紫外分光光度法1-2011.ppt
- 中国药科大学辅导班紫外可见分光光度法.ppt
- 第六章 荧光分光光度法.ppt
- 第九章紫外-可见分光光度法.ppt
- 第十章 分光光度法.ppt
- 分光光度法-血糖.ppt
- 分光光度法补充3.ppt
- 1-2 紫外可见分光光度法2.ppt
- 7可见分光光度法.ppt
- 16 紫外-可见分光光度法.ppt
- AAS原子吸收分光光度法.ppt
- 第一章3原子吸收分光光度法1.ppt
- 实验一 分光光度法(针推).ppt
- 紫外分光光度法鉴定未知芳香化合物及萘的测定.ppt
- 151104大米中直链淀粉和支链淀粉的检测分光光度法.doc
- 实验二 邻二氮菲分光光度法测定水中微量铁