- 219.35 KB
- 3页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'·生物技术·北方园艺2013(08):116~118分光光度法测定高浓度培养液下的产油酵母菌生长曲线马勇,图雅,陈秀莉,门中华(包头师范学院生物科学与技术学院,内蒙古包头014030)摘要:采用分光光度法测定酵母菌不同生长时间高浓度培养液的OD600值,并对不同生长时间高浓度培养液进行相应倍数的稀释,使用建立OD600值回归方程的方法,利用回归后的OD600值绘制出产油酵母菌Y1的生长曲线。结果表明:所得到的生长曲线可以准确反应菌体的生长规律。酵母菌Y1在适宜生长条件下菌体细胞生长出现4个阶段:延滞期、对数期、稳定期和衰亡期,其中,0~4h为延滞期,4~24h为对数生长期,24~68h为稳定期,68h以后进入衰亡期。该研究旨在为相关研究人员提供类似问题的详细解决办法和重要参考。关键词:产油酵母;分光光度法;生长曲线;回归方程中图分类号:Q943.1文献标识码:A文章编号:1001-0009(2013)08-0116-03我国人均石化资源贮量十分有限,而能源需求量却光度法测定酵母菌不同生长时间高浓度培养液的OD600与日俱增。微生物油脂是石化能源替代品生物柴油的值,并对不同生长时间高浓度培养液进行相应倍数的[1]潜在油源。由微生物生产富含多种生理功能的不饱稀释,使得稀释后的培养液所测得的OD600值均保持在[3]和脂肪酸油脂已引起国内外的广泛重视。因此,微生物0.1~0.8之间,然后建立相关稀释倍数间的OD600值[2]油脂的研究将成为新世纪油脂工业的一个发展方向。回归方程,使所有实际测得的OD600值均回归到同一稀在进行产油酵母的研究中,能够准确测定所使用菌种的释倍数所表现的回归后OD600值,最终确定了其生长生长量以及后期测定所用菌种的生长曲线,对于了解所曲线。用菌种以及后期的发酵产脂培养是十分重要的一项生1材料与方法[3]理指标。生长曲线反映了酵母菌在培养过程中的生1.1试验材料长和繁殖的规律,同一种酵母菌因研究方法不同其生长供试菌种为产油酵母菌Y1,由包头师范学院生物[3]曲线也不一样。通过测定酵母菌的生长曲线,了解其科学与技术学院实验中心保藏。生长繁殖规律,这对根据不同的需要,有效地利用和控培养基:YEPD液体培养基(g/L):1L培养基中含[4]制酵母菌的生长具有重要的意义。葡萄糖20g,酵母粉10g,蛋白胨10g;液体种子培养基该研究对实验室保藏的1株产油酵母菌,通过分光(g/L):1L培养基中含葡萄糖20g,(NH),42SO45gKH2PO41g,酵母粉0.5g,MgSO4·7H2O0.5g。第一作者简介:马勇(1980-),男,辽宁台安人,在读博士,实验师,1.2试验方法现主要从事微生物油脂及植物生理与农作物基因工程等研究1.2.1酵母菌Y1种子液的培养取活化后斜面酵母工作。菌Y1一环,接种于100mL液体YEPD培养基中,28℃责任作者:门中华(1975-),男,内蒙古包头人,博士,副教授,硕士180r/min培养14h,备用。生导师,现主要从事植物生理生态学及分子生物学等研究工作。基金项目:国家自然科学基金资助项目(31160254);包头师范学院1.2.2酵母菌Y1不同生长时间培养液收集取20个青年科学研究基金资助项目(BSYKJ2011-17)。100mL已灭菌的三角瓶分别装入25mL液体种子培养收稿日期:2012-12-13基,标签编号,其中1个标注为CK,另外将19个三角瓶wasMSbasalmediumcontaining6g/Lsucrose,4.0g/Lagarpowderand10g/Lmannitesupplementedwith2.0mg/LCCC,2.0mg/LPP333and2.0mg/LABA,inanilluminatedchambrunder14~16hphotoperiodof1500lxlightintensityat20℃,morethan50%conservationmaterialsurvivedafter300days,mostofthemcouldgrewwellonpropagationmedium,andthechromosomenumbermaintainedstably.Keywords:ZingiberofficinaleRosc.;germplasmresource;invitroconservation;growthrecovery;geneticstability116
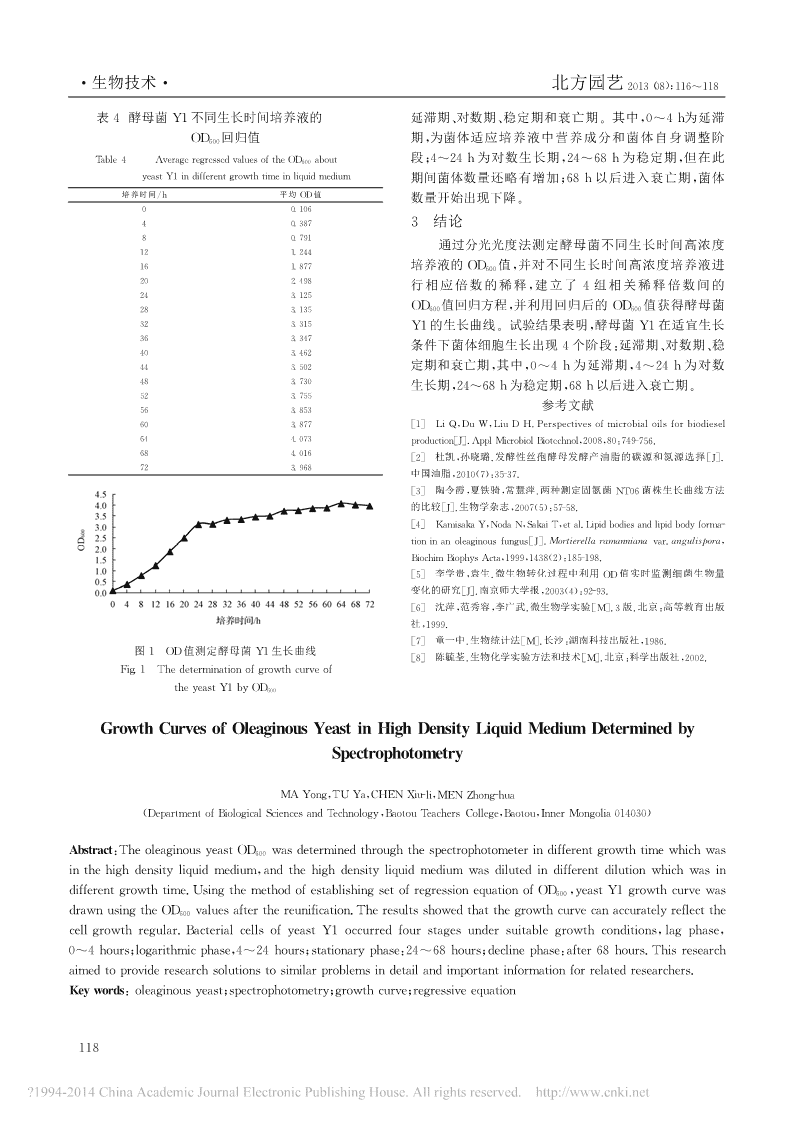
北方园艺2013(08):116~118·生物技术·从0~72h,每间隔4h,分别标明培养时间。分别向已过程中共做5次稀释,稀释倍数分别为2、10、20、30、50,装入液体种子培养基的三角瓶中接入上述培养液因此需要建立4组相应稀释倍数间的OD600值回归0.1mL,震荡摇匀后,将CK和0的2个三角瓶取出,立方程。即放入4℃冰箱贮存。将其余已接入培养液的18个三2.2酵母菌Y1不同生长时间菌悬液OD值测定回归角瓶于28℃180r/min震荡培养,以后每隔4h后取出方程的建立三角瓶,测定该瓶中的菌悬液OD。分别测定酵母菌Y1培养液在12、16、20、24、28h稀1.2.3酵母菌Y1不同生长时间菌悬液OD值测定释相应倍数后的OD600值。由表2可知,随着菌体培养以无菌的液体种子培养基作为空白对照,调节仪器0位时间的增加,在同一培养时间但不同稀释倍数的菌悬液和透光率100%。用1cm比色杯,加入未接种的CK样中测定2组OD600值,所测得数值均在合理范围之内,可品调仪器0位。在600nm波长下测定酵母菌Y1不同用于回归方程系数的计算。生长时间培养液的OD600值,每份样品测定3次取其平表2酵母菌Y1不同稀释倍数培养液的OD600值均值。若菌悬液太浓,应适当稀释,使OD值在0.1~0.8Table2OD600valueofyeastY1mediumwithdifferentdilution之间,并记录相应培养液全部培养时间、稀释倍数、培养时间/h平均OD值(稀释倍数)121.311(0)OD600值。120.256(10)1.2.4酵母菌Y1不同生长时间菌悬液OD值测定回161.621(0)归方程的建立对于较浓的培养液,在做适当稀释测160.427(10)得OD600值后,需补测在同一稀释倍数区间内的任意2160.227(20)200.596(10)组OD600值在下一稀释倍数区间内被稀释到此稀释倍200.313(20)数时的OD600值,每份样品测定3次取其平均值。设酵200.204(30)母菌Y1培养液不同稀释倍数间的OD600值回归方程240.382(20)[5]240.235(30)为y=ax+b(x为相同培养时间培养液稀释后的240.121(50)OD600值,y为相同培养时间培养液稀释前的OD600值),280.307(30)通过解得a、b值后得到不同稀释倍数间的OD600值回归280.191(50)方程。然后将相应的OD600值带入相关回归方程后得到将表2中数据代入y=ax+b可得培养液相应稀释同一稀释倍数水平上的回归后所有OD600值,以培养时倍数间的OD600值回归方程。由表3可知,随着菌体生间为横坐标,以回归后与培养时间对应的OD600值作为长时间的增加,菌体培养液分别被稀释10、20、30、50倍纵坐标,绘制酵母菌Y1的生长曲线。时,每个稀释倍数由低到高的OD600值回归方程分别为2结果与分析y=1.8129x+0.8469、y=1.9651x-0.0190、y=2.2258x-0.1411、y=1.0286x+0.1105。2.1酵母菌Y1不同生长时间培养液的OD600值表3酵母菌Y1不同稀释倍数间的由表1可知,测定酵母菌Y1不同生长时间培养液OD600值回归方程表1酵母菌Y1不同生长时间培养液的OD600值Table3RegressiveequationsofOD600aboutTable1OD600valueofyeastY1mediumwithdifferentgrowthtimeyeastY1indifferentdilution培养时间/h平均OD600值(稀释倍数)培养液稀释倍数OD600值回归方程00.106(0)0~10y=1.8129x+0.846940.387(0)80.791(2)10~20y=1.9651x-0.0190120.219(10)20~30y=2.2258x-0.1411160.568(10)30~50y=1.0286x+0.1105200.473(20)240.355(30)2.3酵母菌Y1生长曲线的绘制280.239(50)将相应稀释倍数的菌体培养液OD600值带入对应回320.261(50)360.265(50)归方程后得到同一稀释倍数水平上的回归后所有OD600400.279(50)值。由表4可知,菌体在培养过程中每4h取样,培养液440.284(50)480.312(50)经相对应回归方程后得到回归后OD600值,其数值能够520.315(50)准确的体现该菌体的生长规律。560.327(50)600.330(50)以培养时间为横坐标,以表4中OD600回归值作为640.354(50)纵坐标,绘制酵母菌Y1的生长曲线。由图1可知,酵母680.347(50)720.341(50)菌Y1在适宜生长条件下菌体细胞生长出现4个阶段:117
·生物技术·北方园艺2013(08):116~118表4酵母菌Y1不同生长时间培养液的延滞期、对数期、稳定期和衰亡期。其中,0~4h为延滞OD600回归值期,为菌体适应培养液中营养成分和菌体自身调整阶Table4AverageregressedvaluesoftheOD600about段;4~24h为对数生长期,24~68h为稳定期,但在此yeastY1indifferentgrowthtimeinliquidmedium期间菌体数量还略有增加;68h以后进入衰亡期,菌体培养时间/h平均OD值数量开始出现下降。00.10640.3873结论80.791通过分光光度法测定酵母菌不同生长时间高浓度121.244161.877培养液的OD600值,并对不同生长时间高浓度培养液进202.498行相应倍数的稀释,建立了4组相关稀释倍数间的243.125283.135OD600值回归方程,并利用回归后的OD600值获得酵母菌323.315Y1的生长曲线。试验结果表明,酵母菌Y1在适宜生长363.347条件下菌体细胞生长出现4个阶段:延滞期、对数期、稳403.462443.502定期和衰亡期,其中,0~4h为延滞期,4~24h为对数483.730生长期,24~68h为稳定期,68h以后进入衰亡期。523.755参考文献563.853603.877[1]LiQ,DuW,LiuDH.Perspectivesofmicrobialoilsforbiodiesel644.073production[J].ApplMicrobiolBiotechnol,2008,80:749-756.684.016[2]杜凯,孙晓璐.发酵性丝孢酵母发酵产油脂的碳源和氮源选择[J].723.968中国油脂,2010(7):35-37.[3]陶令霞,夏铁骑,常慧萍.两种测定固氮菌NT06菌株生长曲线方法的比较[J].生物学杂志,2007(5):57-58.[4]KamisakaY,NodaN,SakaiT,etal.Lipidbodiesandlipidbodyforma-tioninanoleaginousfungus[J].Mortierellaramannianavar.angulispora,BiochimBiophysActa,1999,1438(2):185-198.[5]李学贵,袁生.微生物转化过程中利用OD值实时监测细菌生物量变化的研究[J].南京师大学报,2003(4):92-93.[6]沈萍,范秀容,李广武.微生物学实验[M].3版.北京:高等教育出版社,1999.[7]童一中.生物统计法[M].长沙:湖南科技出版社,1986.图1OD值测定酵母菌Y1生长曲线[8]陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002.Fig.1ThedeterminationofgrowthcurveoftheyeastY1byOD600GrowthCurvesofOleaginousYeastinHighDensityLiquidMediumDeterminedbySpectrophotometryMAYong,TUYa,CHENXiu-li,MENZhong-hua(DepartmentofBiologicalSciencesandTechnology,BaotouTeachersCollege,Baotou,InnerMongolia014030)Abstract:TheoleaginousyeastOD600wasdeterminedthroughthespectrophotometerindifferentgrowthtimewhichwasinthehighdensityliquidmedium,andthehighdensityliquidmediumwasdilutedindifferentdilutionwhichwasindifferentgrowthtime.UsingthemethodofestablishingsetofregressionequationofOD600,yeastY1growthcurvewasdrawnusingtheOD600valuesafterthereunification.Theresultsshowedthatthegrowthcurvecanaccuratelyreflectthecellgrowthregular.BacterialcellsofyeastY1occurredfourstagesundersuitablegrowthconditions,lagphase,0~4hours;logarithmicphase,4~24hours;stationaryphase:24~68hours;declinephase:after68hours.Thisresearchaimedtoprovideresearchsolutionstosimilarproblemsindetailandimportantinformationforrelatedresearchers.Keywords:oleaginousyeast;spectrophotometry;growthcurve;regressiveequation118'
您可能关注的文档
- 新项目方法验证总结-gb5750.4 - 挥发酚类 4-氨基安替吡啉三氯甲烷萃取分光光度法、直接分光光度法
- 有机波谱分析 实验一、紫外分光光度法表征共轭有机化合物
- DB32∕T 385-2007 菜籽粕中异硫氰酸酯的测定 分光光度法
- 原子吸收分光光度法分析手册
- 红外分光光度法(原创)
- 酚试剂分光光度法测室内甲醛含量毕业论文可编辑精选
- 紫外分光光度法测定皮革中的戊二醛含量
- 分光光度法(习题库)
- 磺基水杨酸-铁(ⅲ)分光光度法测定vc探究
- 水质 氨氮的测定 纳氏试剂分光光度法
- 《红外分光光度法》doc版
- 中国药品检验标准操作规范2010年版26红外分光光度法
- 在线浓缩-流动注射分光光度法测定海水中痕量cd(ⅱ)和cu(ⅱ)的方法分析
- 分光光度法测定叶绿素含量
- 室内的空气中甲醛取样与测定-ahmt分光光度法
- 分光光度法测定铜的最新进展_姜瑞芬
- 分光光度法共同测定芦荟中微量铁和锌_潘仲巍
- ppm htv型甲醛速测仪与ahmt分光光度法的可比性研究new