- 161.26 KB
- 4页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档由网友投稿或网络整理,如有侵权请及时联系我们处理。
'第34卷分析化学(FENXIHUAXUE)研究简报特刊2006年9月ChineseJournalofAnalyticalChemistryS227~S230分光光度法快速测定乳链菌肽效价*1112吴兆亮贾永生谭相伟于广和12(河北工业大学生物工程系,天津300130)(天津康益生物有限公司,天津300130)摘要为了解决琼脂扩散法测定乳链菌肽效价时间长的问题,引进了分光光度测定法。确定的测定工艺为:藤黄微球菌接种接种龄为指数期的中后期、接种量为10%的,加入待检样品在温度33e、转速150r/min的摇床培养5h,600nm波长下测定吸光度值,通过乳酸菌肽浓度与检测菌吸光度之间的函数关系准确测量乳酸菌肽的效价。重复测定的最大相对误差在?5%以内。关键词乳链菌肽,效价,快速测定,分光光度法1引言乳酸链球菌素(nisin),又称乳链菌肽,是由乳品发酵微生物Lactococcuslactisssplactis产生的一个多+[1,2]肽抗菌物质,能有效抑制引起食品腐败变质的革兰氏阳性菌(G)及病原菌的繁殖,是一种纯天然食品防腐剂。目前,我国已批准乳链菌肽可以作为一种纯天然食品防腐剂使用,广泛用于乳制品、发酵[3]饮品、罐藏食品,肉类及肉制品的防腐保鲜等。乳酸链球菌素的生产方法为微生物发酵法。目前,用于检测乳酸链球菌素生物活性的最常用方法[4]是琼脂扩散法,其原理是在琼脂表面利用检测菌的生长显示出抑菌效果。为了提高测定的准确性,[5]++辛宇等研究了二剂量法影响因素,确定了效价计算的C运算程序。但运用该法检测所需时间超过20h的培养才能观察到清晰的抑菌圈从而得到准确的结果,不能满足工业生产中快速反馈各生产环节[6]产品生物活性的要求。在乳酸链球菌素的发酵生产过程中,必须随时掌握发酵以及分离过程中乳酸链球菌素的变化情况,以便及时改变生产工艺条件,特别是只有确定分离后的乳酸链球菌素的效价,才能进行喷雾干燥操作。然而目前工业生产过程中主要根据经验进行操作,因此很有必要开发一种快速[7][8]准确的效价检测方法。Flores等利用试管培养法定量测定Nisin生物活性。Turcotte等以厌氧菌片球菌为指示菌,运用96孔聚乙烯板法,并利用自制的微盘分光光度计对比浊度法测定了Nisin生物活性。本研究利用的指示剂为普遍应用于抗生素效价测定的藤黄微球菌,采用有氧摇床培养的方法,深入地研究了乳酸链球菌素活性的影响因素,建立了分光光度法快速测定乳酸链球菌素生物活性的方法。2实验部分2.1仪器及试剂752型可见分光光度计(上海精密科学仪器有限公司);检测指示菌藤黄微球菌的培养用摇床;200LL及1000LL微量加样器(SOCOREX.Swiss公司);5mL加样器及50mL分装瓶(BRAND.Germany公司)。Nisin标准品(Sigma公司),藤黄微球菌Micrococcusluteus(天津康益生物工程有限公司)。其它药品均为国产分析纯试剂。2.2实验方法62.2.1Nisin标准液的配制准确称取10mgNisin标准品(10IU/mL),溶于10mL0102mol/LHCl3中,配制成10IU/mLNisin标准液备用,需要时用0102mol/LHCl稀释成1125、215、5、10、20和40IU/mL6种效价的标准溶液。2.2.2检测菌菌悬液的制备将检测菌接至斜面37e培养箱中培养48h,置于冰箱备用,贮存期不超过14d。自斜面取检测菌接入100mL三角瓶中置于摇床培养若干小时后置于冰箱备用,作为检测时的种子液。2005-10-21收稿;2006-01-17接受
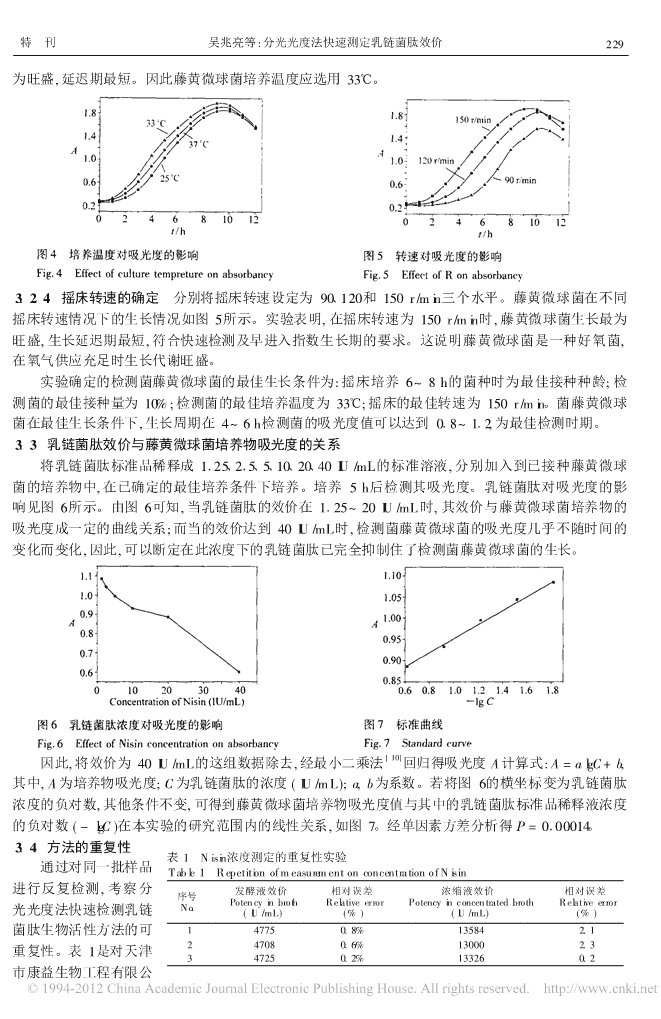
228分析化学第34卷[9]2.2.3CM检测培养基的制备Tween20与水(1+1)混和物012%,胰蛋白胨018%,葡萄糖015%,HCl015%,酵母抽提物015%,Na2HPO4012%,pH618。115e灭菌20min。具体方法是将检测菌接种到液体培养基中,同时向其中加入一定浓度的Nisin溶液,然后将已接种的培养基放入摇床中在一定条件下进行培养。在此过程中,Nisin对检测菌的生长形成抑制作用,这种抑制作用的大小取决于加入的Nisin溶液浓度以及接入的检测菌浓度和生长活性。因此,如能将接入的检测菌标准化,那么在相同的条件下检测菌的生长与加入的Nisin生物活性呈一定函数关系,这种关系就可通过Nisin效价与检测菌吸光度的关系而得到反映。3结果与讨论3.1藤黄微球菌生长曲线的确定分光光度法快速检测样品中乳链菌肽生物活性是利用检测指示菌藤黄微球菌培养物对光选择性吸[8]收的分析方法,通过Nisin效价与检测菌吸光度的函数关系进行定量检测。以10%的接种量,通过在37e,摇床转速120r/min条件下培养藤黄微球菌,600nm处每小时检测一次培养物的吸光度,结果如图1所示。藤黄微球菌在自然状态下生长时,其延迟期一般为1~2h,该时期菌体生长缓慢,菌量基本上维持在最低水平不变;然后进入指数期,大约持续5~6h,该时期菌体新陈代谢最为旺盛,繁殖迅速,指数期生长速率常数最大,菌体总量迅速增长;8h后进入稳定期,菌体总量基本不变,菌体生长量和死亡量基本持平,菌体总量处于动态平衡状态;随着时间的消逝,稳定期很快过去,10h后进入衰亡期,菌体衰亡率开始高于生长率,大量菌体开始死亡,菌体总量开始减少。图1藤黄微球菌的生长曲线图2接种种龄对吸光度的影响Fig.1CellgrowthcurveofmicrococcusluteusFig.2Effectofageofinjectiononabsorbancyu延迟期(thelaggrowthphase);p指数期中后期(themiddle3.2藤黄微球菌最佳生长条件的确定andlaterstageoftheexponentialgrowthphase);w指数期前期3.2.1种子液种龄的影响接种处于不同生长阶(theearlierstageoftheexponentialgrowthphase);"稳定期(the段的种子液,接种龄对吸光度的影响如图2所示。stablegrowthphase)。结果表明菌种的接种龄为指数期特别是指数期中后期菌种,可以明显缩短延迟期。因此检测时应该将指数期中后期的菌种作为种子液进行接种,以缩短测量时菌种的延迟期,也可以保证接种菌种活性的稳定性。3.2.2检测菌接种量的影响改变接种量,接种量都应控[9]制在10%以内。以接种量分别为215%、510%、10%接种培养,其他条件同上,结果表明,接种量的改变对延迟期的长短有显著的影响。藤黄微球菌在不同接种量时的生长情况如图3所示。由图3可以看出接种量为10%时,可以达到缩短延迟期,及早进入指数期进行检测的目的。3.2.3检测菌培养温度的影响改变培养温度,研究藤黄微球菌的最佳生长温度,以便尽快进入指数期检测乳链菌图3接种量对吸光度的影响肽生物活性。藤黄微球菌在不同温度下的生长情况如图4Fig.3Effectoftheinjectionamountonabsor-所示。实验表明,藤黄微球菌在33e时新陈代谢和生长最bancy
特刊吴兆亮等:分光光度法快速测定乳链菌肽效价229为旺盛,延迟期最短。因此藤黄微球菌培养温度应选用33e。3.2.4摇床转速的确定分别将摇床转速设定为90、120和150r/min三个水平。藤黄微球菌在不同摇床转速情况下的生长情况如图5所示。实验表明,在摇床转速为150r/min时,藤黄微球菌生长最为旺盛,生长延迟期最短,符合快速检测及早进入指数生长期的要求。这说明藤黄微球菌是一种好氧菌,在氧气供应充足时生长代谢旺盛。实验确定的检测菌藤黄微球菌的最佳生长条件为:摇床培养6~8h的菌种时为最佳接种种龄;检测菌的最佳接种量为10%;检测菌的最佳培养温度为33e;摇床的最佳转速为150r/min。菌藤黄微球菌在最佳生长条件下,生长周期在4~6h检测菌的吸光度值可以达到018~112,为最佳检测时期。3.3乳链菌肽效价与藤黄微球菌培养物吸光度的关系将乳链菌肽标准品稀释成1125、215、5、10、20、40IU/mL的标准溶液,分别加入到已接种藤黄微球菌的培养物中,在已确定的最佳培养条件下培养。培养5h后检测其吸光度。乳链菌肽对吸光度的影响见图6所示。由图6可知,当乳链菌肽的效价在1125~20IU/mL时,其效价与藤黄微球菌培养物的吸光度成一定的曲线关系;而当的效价达到40IU/mL时,检测菌藤黄微球菌的吸光度几乎不随时间的变化而变化,因此,可以断定在此浓度下的乳链菌肽已完全抑制住了检测菌藤黄微球菌的生长。[10]因此,将效价为40IU/mL的这组数据除去,经最小二乘法回归得吸光度A计算式:A=algC+b,其中,A为培养物吸光度;C为乳链菌肽的浓度(IU/mL);a,b为系数。若将图6的横坐标变为乳链菌肽浓度的负对数,其他条件不变,可得到藤黄微球菌培养物吸光度值与其中的乳链菌肽标准品稀释液浓度的负对数(-lgC)在本实验的研究范围内的线性关系,如图7。经单因素方差分析得P=0100014。3.4方法的重复性表1Nisin浓度测定的重复性实验通过对同一批样品Table1RepetitionofmeasurementonconcentrationofNisin进行反复检测,考察分发酵液效价相对误差浓缩液效价相对误差序号PotencyinbrothRelativeerrorPotencyinconcentratedbrothRelativeerror光光度法快速检测乳链No.(IU/mL)(%)(IU/mL)(%)菌肽生物活性方法的可147750.8%135842.1247080.6%130002.3重复性。表1是对天津347250.2%133260.2市康益生物工程有限公
230分析化学第34卷司其中一批产品生产过程中的发酵液和浓缩液的3次检测结果。实验表明,对同一批样品多次检测所得结果相对误差均小于5%,符合工业检测的要求。由琼脂扩散法得到的这两个样品的效价分别为4750IU/mL和13250IU/mL,这与分光光度法所得结果的最大相对误差分别为019%和215%,由此可见,分光光度法与琼脂扩散法在测量精度上是一致的。3.5小结(1)利用分光光度法快速检测乳链菌肽生物活性,检测时间可由琼脂扩散法的20h缩短到5h;(2)利用分光光度法快速检测样品中乳链菌肽生物活性具有良好的可操作性,通过乳酸菌肽的浓度与检测菌的吸光度之间的函数关系可以准确测量乳酸菌肽的效价;(3)此方法的重复性好,反复测定同一样品,其最大相对误差均在?5%范围内。References1SetvensKA,SheldonBW,KlapesNA.Appl.Environ.Microbiol.,1991,(57):3613~36152VandenberghPA.FEMSMicrobiologyReview,1993,(12):221~2383TianWenli(田文利),WuQiong(吴琼),LôHongxian(吕红线),WangJin(王锦).FoodIndustry(食品工业),2000,(3):28~304TramerJ,FowlerGG.Sci.FoodAgr.,1964,15(8):453~4565XinYu(辛宇),WuZhaoliang(吴兆亮),YuGuanghe(于广和).JournalofHebeiUniversityofTechnology(河北工业大学学报),2005,34(1):80~846WuQiong(吴琼).FoodSciences(食品科学),1999,(6):56~597FloresSH,BragaA,AlegreRM.BraziliamArchivesofBiologyandTechnology,2003,46(6):479~4818TurcotteC,LacroixC,KheadrB,GrignonL,FlissIA.INJFoodMicrobiol.,2004,90:283~2939YiShouliang(伊守亮),XiaoLin(肖林),GuZhenghua(顾正华),ZhangKechang(章克昌).JournalofWuxiUniversi-tyofLightIndustry(无锡轻工业大学学报),2004,23(4):41~45Fast-DetectionofthePotencyofNisinbySpectrophotometry*1112WuZhaoliang,JiaYongsheng,TanXiangwei,YuGuanghe1(DepartmentofBioengineering,HebeiUniversityofTechnology,Tianjin300130)2(KangyiBioengineeringLimitCompany,Tianjin300130)AbstractTodealwiththelong-timingoftheagardiffusiontechnique,anewmethodwasestablishedforthefast-detectionofbioactivityofnisinbyspectrophotometerontheopticaldensityoftheculturedindicativestrain-Micrococcusluteus.Thenewmethodusesinoculatingageisthemetaphaseoranaphaseofexponentialphaseofgrowth,inoculatingrateis10%,theculturingtemperatureis33e,therotatespeedofshakeris150r/min,after5hoursculturemeasuredat600nm.AnditwasfinallyformatedamathematicalequationtodetecttheconcerntrationofNisin.TheRSDisin?5%.KeywordsNisin,potency,fas-tdetection,spectrophotometry(Received21Octorber2005;accepted17January2006)'
您可能关注的文档
- 分光光度法测电离常数
- COD重铬酸钾分光光度法
- 甲醛吸收_副玫瑰苯胺分光光度法测定水中
- 分光光度法测定_淀粉酶活力
- 紫外分光光度法测定枸杞中多糖含量
- 荧光分光光度法测定生活用纸制品中的荧光增白剂
- 微量钼G的质子化壳聚糖富集和分光光度法测定
- 分光光度法测定山楂叶提取物中总黄酮的含量_张文莉
- 亚甲基蓝分光光度法-硫化氢
- 分光光度法测定酸碱调节剂中氨丁三醇的含量
- 分光光度法测食用油氧化物过氧化值的含量
- 水质 三氯乙醛的测定 毗唑啉酮分光光度法[HJ T50-1999]
- 紫外分光光度法快速测定溶液中微量碘离子
- 硼酸碘化钾分光光度法测定大气中臭氧
- 比光谱_导数分光光度法同时测定对_香豆酸和阿魏酸
- 分光光度法测定芦荟中微量元素锌
- DB34T 815-2008 饲料中汞的测定 原子氢化物分光光度法
- 分光光度法测定天然维生素E总含量